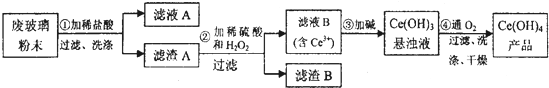
题目内容
实验室可用Fe2(SO4)3稀溶液做刻蚀液洗去试管中的银镜:Fe3++Ag?Fe2++Ag+
(1)Fe2(SO4)3溶液显酸性,原因是 (用离子方程式表示).
(2)有同学提出用FeCl3溶液代替Fe2(SO4)3除Ag效果更好,其理由是 .
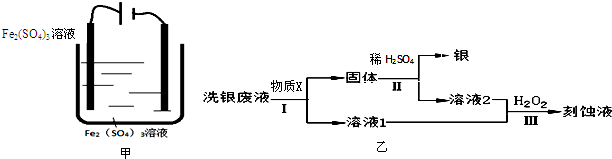
(3)如果将题设原理设计成电解法洗Ag(如图甲),阴极反应为 .
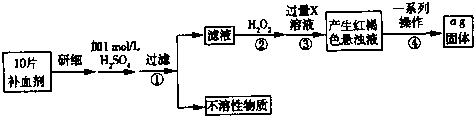
(4)乙同学欲从洗银废液(Fe3+、Fe2+、Ag+、SO42-)中回收银和刻蚀液,设计了如图乙路线:
①物质X是 .
②过程Ⅱ涉及到的分离方法是 .
③过程Ⅲ在酸性条件下的离子方程式是 ;若要在该条件下得到最大量的Fe2(SO4)3,根据下表提供的信息,则应该控制该溶液的pH范围是

(1)Fe2(SO4)3溶液显酸性,原因是
(2)有同学提出用FeCl3溶液代替Fe2(SO4)3除Ag效果更好,其理由是
(3)如果将题设原理设计成电解法洗Ag(如图甲),阴极反应为
(4)乙同学欲从洗银废液(Fe3+、Fe2+、Ag+、SO42-)中回收银和刻蚀液,设计了如图乙路线:
①物质X是
②过程Ⅱ涉及到的分离方法是
③过程Ⅲ在酸性条件下的离子方程式是
| 沉淀物 | 开始沉淀pH | 完全沉淀pH |
| Fe(OH)3 | 2.0 | 3.0 |
考点:物质分离和提纯的方法和基本操作综合应用,盐类水解的原理,电解原理
专题:
分析:(1)铁离子水解生成氢氧化铁和氢离子,溶液呈酸性;
(2)依据反应Fe3++Ag?Fe2++Ag+,Cl-+Ag+=AgCl↓从而促进上述Fe3++Ag?Fe2++Ag+反应平衡正向移动;
(3)电解法除银,应把含银的试管作阳极,银溶解,阴极铁离子得电子发生还原反应;
硝酸根离子在酸溶液中具有氧化性,可以氧化银、亚铁离子;
(4)洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;过程Ⅱ中加入的稀硫酸是溶解过量的铁,要得到银需进行过滤,把溶液和银分开,刻蚀液成分为铁离子,故需用过氧化氢把亚铁离子氧化,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,从铁离子沉淀pH可知,pH为2.0开始沉淀,pH为3沉淀完全,故应控制pH小于2.0.
①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;
②试剂Ⅱ是溶解过量的铁;
③过氧化氢具有强氧化性,把亚铁离子氧化,从铁离子沉淀pH可知,控制pH小于2.0.
(2)依据反应Fe3++Ag?Fe2++Ag+,Cl-+Ag+=AgCl↓从而促进上述Fe3++Ag?Fe2++Ag+反应平衡正向移动;
(3)电解法除银,应把含银的试管作阳极,银溶解,阴极铁离子得电子发生还原反应;
硝酸根离子在酸溶液中具有氧化性,可以氧化银、亚铁离子;
(4)洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;过程Ⅱ中加入的稀硫酸是溶解过量的铁,要得到银需进行过滤,把溶液和银分开,刻蚀液成分为铁离子,故需用过氧化氢把亚铁离子氧化,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,从铁离子沉淀pH可知,pH为2.0开始沉淀,pH为3沉淀完全,故应控制pH小于2.0.
①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;
②试剂Ⅱ是溶解过量的铁;
③过氧化氢具有强氧化性,把亚铁离子氧化,从铁离子沉淀pH可知,控制pH小于2.0.
解答:
解:(1)Fe2(SO4)3溶液显酸性是因为铁离子水解生成氢氧化铁和氢离子;
反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)FeCl3溶液洗银,发生反应为:Fe3++Ag?Fe2++Ag+,Cl-+Ag+=AgCl↓,从而促进上述Fe3++Ag?Fe2++Ag+反应平衡正向移动;故答案为:Cl-+Ag+=AgCl↓从而促进上述Fe3++Ag?Fe2++Ag+反应平衡正向移动;
(3)电解法除银,应把含银的试管作阳极,银溶解,Ag-e-=Ag+,
阴极铁离子得电子发生还原反应,反应式为:Fe3++e-=Fe2+;
故答案为:Fe3++e-=Fe2+;
(4)①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;反应的离子方程式为:2Fe3++Fe=3Fe2+,Fe+2Ag+=Fe2++2Ag;
故答案为:铁;
②过程Ⅱ中加入的稀硫酸是溶解过量的铁,得到银,分离银需进行过滤,把溶液和银分开,
故答案为:过滤;
③过氧化氢具有强氧化性,把亚铁离子氧化,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,从铁离子沉淀pH可知,pH为2.0开始沉淀,pH为3沉淀完全,故应控制pH小于2.0.
反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)FeCl3溶液洗银,发生反应为:Fe3++Ag?Fe2++Ag+,Cl-+Ag+=AgCl↓,从而促进上述Fe3++Ag?Fe2++Ag+反应平衡正向移动;故答案为:Cl-+Ag+=AgCl↓从而促进上述Fe3++Ag?Fe2++Ag+反应平衡正向移动;
(3)电解法除银,应把含银的试管作阳极,银溶解,Ag-e-=Ag+,
阴极铁离子得电子发生还原反应,反应式为:Fe3++e-=Fe2+;
故答案为:Fe3++e-=Fe2+;
(4)①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;反应的离子方程式为:2Fe3++Fe=3Fe2+,Fe+2Ag+=Fe2++2Ag;
故答案为:铁;
②过程Ⅱ中加入的稀硫酸是溶解过量的铁,得到银,分离银需进行过滤,把溶液和银分开,
故答案为:过滤;
③过氧化氢具有强氧化性,把亚铁离子氧化,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,从铁离子沉淀pH可知,pH为2.0开始沉淀,pH为3沉淀完全,故应控制pH小于2.0.
点评:本题考查了盐类水解的应用,回收利用的提取过程盐类分析判断,试剂选择的目的,电解原理,离子方程式化学方程式书写的方法,掌握物质性质是关键,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列叙述中不正确的是( )
| A、将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3 |
| B、溶液中c(H+)>c(OH-),该溶液一定显酸性 |
| C、用原电池作电源进行电解时,电子从原电池负极流向电解池阴极 |
| D、外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池 |