题目内容
17.在含2molH2SO4的浓硫酸中加入足量的锌粉,使其充分反应,下列推断中错误的是( )①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
| A. | ① | B. | ② | C. | ②③ | D. | ①② |
分析 2mol浓硫酸和足量锌粉混合,浓硫酸和锌反应生成硫酸锌和二氧化硫,浓硫酸在反应过程中变为稀硫酸,稀硫酸和Zn发生置换反应生成氢气,据此分析解答.
解答 解:2mol浓硫酸和足量锌粉混合,浓硫酸和锌反应生成硫酸锌和二氧化硫,浓硫酸在反应过程中变为稀硫酸,稀硫酸和Zn发生置换反应生成氢气,所以放出的气体除SO2外还有H2,因为硫酸中不是S原子得电子、部分氢离子得电子,所以无法计算转移电子物质的量,则①正确、②③错误,故选C.
点评 本题考查浓硫酸性质,为高频考点,明确浓硫酸在反应过程中变为稀硫酸是解本题关键,硫酸浓度不同导致其性质不同,浓硫酸具有强氧化性、但稀硫酸具有弱氧化性,浓硫酸中体现氧化性的元素是S元素、稀硫酸中体现氧化性的元素是H元素,题目难度不大.

练习册系列答案
相关题目
7.用聚光手电筒照射下列分散系,可观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 蛋白质胶体 | C. | KOH溶液 | D. | NaCl溶液 |
5.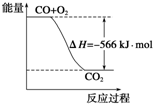 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-532 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023 |
12.下列物质在溶液中电离出的Cl-与1mol CaCl2电离出的Cl-数目相同的是( )
| A. | 2 mol KClO3 | B. | 1 mol KCl | C. | 2 mol MgCl2 | D. | 2 mol NaCl |
2.短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 化合物YX、ZX2、WX3 都是酸性氧化物 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 原子半径的大小顺序:rY>rZ>rW>rX | |
| D. | 元素X 的简单气态氢化物的热稳定性比W 的弱 |
 .Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
.Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.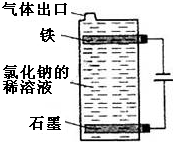 (1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;