题目内容
11.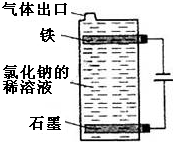 (1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;(2)将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是溶液变红后褪色.
分析 (1)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O;
(2)电解后得到NaClO溶液显碱性,且具有强氧化性.
解答 解:(1)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,
故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(2)电解后得到NaClO溶液,显碱性,且具有强氧化性,滴入酚酞溶液中,观察到溶液变红后褪色,
故答案为:溶液变红后褪色.
点评 本题考查电解原理应用、次氯酸盐的性质,难度不大,侧重考查学生对知识的迁移应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在含2molH2SO4的浓硫酸中加入足量的锌粉,使其充分反应,下列推断中错误的是( )
①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
| A. | ① | B. | ② | C. | ②③ | D. | ①② |
2.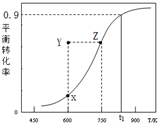 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | 脱氢反应的△H<0 | B. | 在t1K时,该反应的平衡常数为8.1 | ||
| C. | 600K时,Y点甲醇的υ(正)<υ(逆) | D. | 若增大体系压强,曲线将向上平移 |
19.以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )
| A. | Mg片作负极,电极反应:Mg-2e-═Mg2+ | |
| B. | Al片作负极,电极反应:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 电子从Mg电极沿导线流向Al电极 | |
| D. | Al片上有气泡产生 |
6.某原电池结构如图所示,下列有关该原电池的说法正确的是( )
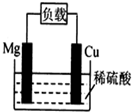

| A. | 电池反应为:Mg+2H+=Mg2++H2↑ | B. | 镁棒发生还原反应 | ||
| C. | 电子从铜棒经外电路流向镁棒 | D. | 铜棒为负极 |
3.铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质].下列说法中正确的是( )
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-═Pb |
20.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A. | v(CO)=0.03 mol/(L•s) | B. | v(NO2)=0.7 mol/(L•min) | ||
| C. | v(N2)=0.4 mol/(L•min) | D. | v(CO2)=1.1 mol/(L•min) |