题目内容
6.把6.4g铜放入足量的浓硫酸中,加热,使得铜完全反应.计算生成的气体的体积(标准状况).分析 发生反应:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,计算Cu的物质的量,根据方程式计算二氧化硫物质的量,再根据V=nVm计算二氧化硫的体积.
解答 解:6.4g Cu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,
Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
0.1mol 0.1mol
故标况下生成二氧化硫的体积为:0.1mol×22.4L/mol=2.24L,
答:标准状况下生成气体的体积为2.24L.
点评 本题考查化学方程式计算,比较基础,明确发生的反应即可解答,有利于基础知识的巩固.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
16.化学是一门与社会、生活、科研密切相关的自然科学.下列有关叙述中,不正确的是( )
| A. | 大量使用燃煤发电是形成雾霾的主要原因之一 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 利用化学反应可实现12C到14C的转化 | |
| D. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 |
17.在含2molH2SO4的浓硫酸中加入足量的锌粉,使其充分反应,下列推断中错误的是( )
①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
①放出的气体除SO2外还有H2 ②只放出1molSO2气体 ③反应结束时转移4mol电子.
| A. | ① | B. | ② | C. | ②③ | D. | ①② |
14.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1L pH=1的HCl溶液中,H+个数为0.1NA | |
| B. | 8.4gNaHCO3溶于水,溶液中含有0.1NA个CO32- | |
| C. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的数目为2NA | |
| D. | 电解精炼铜时,理论上阳极质量每减少64g,则外线路通过电子数为2NA |
1.已知:Na2SO3+H2O+I2=Na2SO4+2HI.现有一无色溶液,可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-.
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-.
| A. | ①③ | B. | ①③④ | C. | ①② | D. | ②③④ |
2.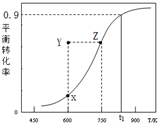 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | 脱氢反应的△H<0 | B. | 在t1K时,该反应的平衡常数为8.1 | ||
| C. | 600K时,Y点甲醇的υ(正)<υ(逆) | D. | 若增大体系压强,曲线将向上平移 |
19.以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )
| A. | Mg片作负极,电极反应:Mg-2e-═Mg2+ | |
| B. | Al片作负极,电极反应:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 电子从Mg电极沿导线流向Al电极 | |
| D. | Al片上有气泡产生 |
20.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A. | v(CO)=0.03 mol/(L•s) | B. | v(NO2)=0.7 mol/(L•min) | ||
| C. | v(N2)=0.4 mol/(L•min) | D. | v(CO2)=1.1 mol/(L•min) |
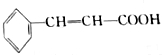 也存在反式结构,1mol
也存在反式结构,1mol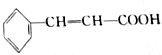 最多可以与4molH2发生加成反应.
最多可以与4molH2发生加成反应.