题目内容
取1.43gNa2CO3?xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mLCO2(标准状况下).求:
(1)Na2CO3?xH2O的摩尔质量;
(2)x值.
(1)Na2CO3?xH2O的摩尔质量;
(2)x值.
考点:化学方程式的有关计算
专题:计算题
分析:根据二氧化碳的体积计算固体的物质的量,进而计算摩尔质量,根据摩尔质量计算x的值.
解答:
解:(1)n(CO2)=
=0.005mol,
n(Na2CO3?xH2O)=n(CO2)=0.005mol,
M(Na2CO3?xH2O)=
=
=286 g/mol,
答:摩尔质量为286g/mol;
(2)由相对分子质量为286可知:106+18x=286,x=10,答:x值为10.
| 0.112L |
| 22.4L/mol |
n(Na2CO3?xH2O)=n(CO2)=0.005mol,
M(Na2CO3?xH2O)=
| m(Na2CO3?xH2O) |
| n(Na2CO3?xH2O) |
| 1.43g |
| 0.005mol |
答:摩尔质量为286g/mol;
(2)由相对分子质量为286可知:106+18x=286,x=10,答:x值为10.
点评:本题考查化学方程式的计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
相关题目
恒温恒容的情况下,反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志 是( )
| A、容器内气体的密度不随时间而变化 |
| B、容器内的总压强不随时间而变化 |
| C、单位时间内生成2nmol AB的同时,生成nmol的B2 |
| D、A2、B2、AB的反应速率比为1:1:2的状态 |
下列混合物能用分液法分离的是( )
| A、乙醇与乙酸 |
| B、苯和溴苯 |
| C、乙酸乙酯和Na2CO3溶液 |
| D、葡萄糖与水的混合液 |
有机物
H3
H═
H-
≡CH中标有“?”的碳原子的杂化方式依次为( )
| C |
| ? |
| C |
| ? |
| C |
| ? |
| C |
| ? |
| A、sp、sp2、sp3 |
| B、sp3、sp2、sp |
| C、sp2、sp、sp3 |
| D、sp3、sp、sp2 |
已知火箭燃料二甲基肼(CH3-NH-NH-CH3)的燃烧热为-6 000kJ?mol-1,则30g二甲基肼完全燃烧放出的热量为( )
| A、3000 kJ |
| B、1500 KJ |
| C、6 000 kJ |
| D、12 000 kJ |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是( )
途径①Fe
FeCl2溶液
途径②Fe
FeCl3
FeCl2溶液
途径③Cl2
Na2SO4溶液
途径④Cl2
NaClO溶液
Na2SO4溶液
途径⑤S
H2SO4
途径⑥S
SO2
SO3
H2SO4.
途径①Fe
| 稀HCl |
途径②Fe
| Cl2 |
| Fe、水 |
途径③Cl2
| Na2SO3溶液 |
途径④Cl2
| NaOH溶液 |
| Na2SO3溶液 |
途径⑤S
| 浓HNO3 |
途径⑥S
| O2 |
| O2 |
| H2O |
| A、由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B、由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C、由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D、以上说法都不正确 |

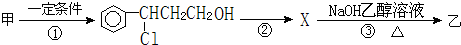
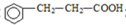 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式