题目内容
铝土矿的主要成分是Al2O3,含有杂质SiO2、MgO.工业上从铝土矿中提取铝可采用如下工艺流程:
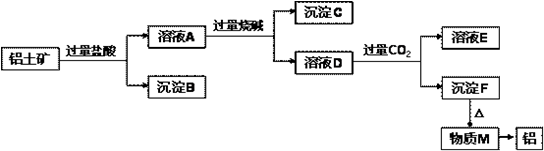
已知:Na[Al(OH)4]+CO2(过量)═NaHCO3+Al(OH)3↓
请回答下列问题:
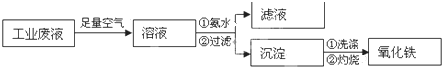
(1)图中涉及分离溶液与沉淀的实验方法是 (填操作名称).
(2)沉淀B的成分是 (填化学式,下同);沉淀C的成分是 ;溶液D中大量存在的阴离子是 .
(3)沉淀F转化为物质M的化学方程式为 ;溶液A与转化为溶液D的离子方程式 .

已知:Na[Al(OH)4]+CO2(过量)═NaHCO3+Al(OH)3↓
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是
(2)沉淀B的成分是
(3)沉淀F转化为物质M的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝土矿的主要成分是Al2O3,含有杂质SiO2、MgO,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2 AlCl3+3H2O、MgO+2HCl=MgCl2+H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、MgCl2和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Mg(OH)2,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、Na[Al(OH)4]+CO2(过量)═NaHCO3+Al(OH)3↓,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al.
解答:
解:铝土矿的主要成分是Al2O3,含有杂质SiO2、MgO,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2 AlCl3+3H2O、MgO+2HCl=MgCl2+H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、MgCl2和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Mg(OH)2,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、Na[Al(OH)4]+CO2(过量)═NaHCO3+Al(OH)3↓,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al,
(1)分离难溶物和溶液采用过滤方法,所以图中涉及分离溶液与沉淀的实验方法是过滤,故答案为:过滤;
(2)通过以上分析知,沉淀B的成分是SiO2,沉淀C的成分是Mg(OH)2;溶液D中含有NaCl、NaOH、NaAlO2,则大量存在的阴离子是Cl-、OH-、AlO2-,
故答案为:SiO2;Mg(OH)2;Cl-、OH-、AlO2-;
(3)F是氢氧化铝,加热氢氧化铝分解生成氧化铝和水,所以沉淀F转化为物质M的化学方程式为2Al(OH)3
Al2O3+3H2O;溶液A与转化为溶液D的离子方程式为Al3++4OH-=AlO2-+2H2O、Mg2++2OH-=Mg(OH)2↓、H++OH-=H2O,
故答案为:2Al(OH)3
Al2O3+3H2O;Al3++4OH-=AlO2-+2H2O、Mg2++2OH-=Mg(OH)2↓、H++OH-=H2O.
(1)分离难溶物和溶液采用过滤方法,所以图中涉及分离溶液与沉淀的实验方法是过滤,故答案为:过滤;
(2)通过以上分析知,沉淀B的成分是SiO2,沉淀C的成分是Mg(OH)2;溶液D中含有NaCl、NaOH、NaAlO2,则大量存在的阴离子是Cl-、OH-、AlO2-,
故答案为:SiO2;Mg(OH)2;Cl-、OH-、AlO2-;
(3)F是氢氧化铝,加热氢氧化铝分解生成氧化铝和水,所以沉淀F转化为物质M的化学方程式为2Al(OH)3
| ||
故答案为:2Al(OH)3
| ||
点评:本题考查混合物的分离和提纯,明确物质性质是解本题关键,知道哪些物质之间能发生化学反应,知道常见物质的分离和提纯方法,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
下列实验操作中错误的是( )
| A、蒸馏操作时,冷凝水的方向应当由下往上 |
| B、分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 |
| C、提取碘水中的碘单质时,应选择有机萃取剂,如酒精 |
| D、萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 |