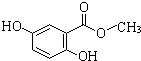
题目内容
自然界中,锰的主要矿石有软锰矿(主要成分MnO2)和菱锰矿(主要成分MnCO3),金属锰的提炼方式主要有火法和湿法两种.
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是 .
湿法炼锰即电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收.其生产工艺流程如图:
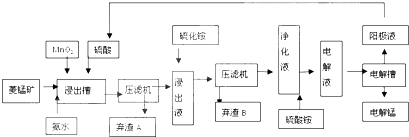
已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+.②生成氢氧化物的pH如表:
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp)
(2)菱锰矿粉与硫酸反应的化学方程式是 .
(3)MnO2的作用是除去菱锰矿的硫酸浸取液中的Fe2+.该除杂过程的离子方程式是 .
(4)使用氨水的目的是调整pH值到 (填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化铵的是 .
(5)电解槽中使用的是惰性电极板,电解反应方程式为 .
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是
湿法炼锰即电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收.其生产工艺流程如图:

已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+.②生成氢氧化物的pH如表:
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(3)MnO2的作用是除去菱锰矿的硫酸浸取液中的Fe2+.该除杂过程的离子方程式是
(4)使用氨水的目的是调整pH值到
(5)电解槽中使用的是惰性电极板,电解反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质,电解原理
专题:实验设计题,元素及其化合物
分析:锰的主要矿石有软锰矿(主要成分MnO2)和菱锰矿(主要成分MnCO3),加入二氧化锰、硫酸和氨水在浸出槽中反应,通过化合浸取、氧化净化及沉淀除杂、电解硫酸锰溶液法得到产品;
(1)金属铝可以和部分金属氧化物之间发生置换反应来冶炼金属;
(2)菱锰矿粉与硫酸反应生成硫酸镁,二氧化碳和水;
(3)二氧化锰具有氧化性,能将亚铁离子氧化为三价铁离子;
(4)氨水可以将铁离子沉淀,根据氢氧化铁的Ksp来计算完全沉淀铁离子所需的溶液的pH即可,硫化铵可以将钴离子以及镍离子沉淀;
(5)根据电解池的工作原理来回答即可.
(1)金属铝可以和部分金属氧化物之间发生置换反应来冶炼金属;
(2)菱锰矿粉与硫酸反应生成硫酸镁,二氧化碳和水;
(3)二氧化锰具有氧化性,能将亚铁离子氧化为三价铁离子;
(4)氨水可以将铁离子沉淀,根据氢氧化铁的Ksp来计算完全沉淀铁离子所需的溶液的pH即可,硫化铵可以将钴离子以及镍离子沉淀;
(5)根据电解池的工作原理来回答即可.
解答:
解:(1)金属铝可以和金属氧化物二氧化锰之间发生置换反应可以据此来冶炼金属锰,3MnO2+4Al
2Al2O3+3Mn;
故答案为:3MnO2+4Al
2Al2O3+3Mn;
(2)菱锰矿粉与硫酸反应生成硫酸镁,二氧化碳和水,化学方程式为:MgCO3+H2SO4=MgSO4+CO2↑+H2O;
故答案为:MgCO3+H2SO4=MgSO4+CO2↑+H2O;
(3)二氧化锰具有氧化性,能将亚铁离子氧化为三价铁离子,MnO2能除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是:4H++2Fe2++MnO2=Mn2++2Fe3++2H2O,故答案为:4H++2Fe2++MnO2=Mn2++2Fe3++2H2O;
(4)氨水可以将铁离子沉淀,氢氧化铁的Ksp=c3(OH-)?c(Fe3+),铁离子完全沉淀时,铁离子的浓度是1×10-5mol/L,此时c(OH-)=
≈10-11.2mol/L,所以c(H+)=10-3.8mol/L,所以pH=3.8,所以将铁离子沉淀完全,但是锰离子未沉淀的范围是3.8~8.3,此范围内Co2+已经沉淀完全,所以再加入硫化铵将Ni2+
沉淀,故答案为:3.8~8.3;将Ni2+沉淀;
(5)根据电解池的工作原理,电解硫酸锰酸性溶液生成二氧化锰、硫酸和氢气,电解反应方程式为:MnSO4+2H2O
MnO2+H2↑+H2SO4,故答案为:MnSO4+2H2O
MnO2+H2↑+H2SO4.
| ||
故答案为:3MnO2+4Al
| ||
(2)菱锰矿粉与硫酸反应生成硫酸镁,二氧化碳和水,化学方程式为:MgCO3+H2SO4=MgSO4+CO2↑+H2O;
故答案为:MgCO3+H2SO4=MgSO4+CO2↑+H2O;
(3)二氧化锰具有氧化性,能将亚铁离子氧化为三价铁离子,MnO2能除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是:4H++2Fe2++MnO2=Mn2++2Fe3++2H2O,故答案为:4H++2Fe2++MnO2=Mn2++2Fe3++2H2O;
(4)氨水可以将铁离子沉淀,氢氧化铁的Ksp=c3(OH-)?c(Fe3+),铁离子完全沉淀时,铁离子的浓度是1×10-5mol/L,此时c(OH-)=
| 3 |
| ||
沉淀,故答案为:3.8~8.3;将Ni2+沉淀;
(5)根据电解池的工作原理,电解硫酸锰酸性溶液生成二氧化锰、硫酸和氢气,电解反应方程式为:MnSO4+2H2O
| ||
| ||
点评:本题是一道实验方案设计的工艺流程题目,考查学生各方面的综合知识能力,难度大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
关于石油化工综合利用的说法不正确的是( )
| A、石油的分馏是将相对分子质量较大分子变成相对分子质量较小分子的过程 |
| B、石油裂化可提高汽油、煤油和柴油等轻质油的产量 |
| C、石油分馏、裂化、裂解获得的产品都是混合物 |
| D、石油是工业的血液,但石油化工及其产品也对生态环境产生了不良影响 |
关于强、弱电解质叙述正确的是( )?
| A、强电解质都是离子化合物,弱电解质都是共价化合物? |
| B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物? |
| C、强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子? |
| D、强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱? |
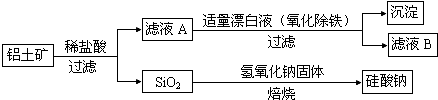

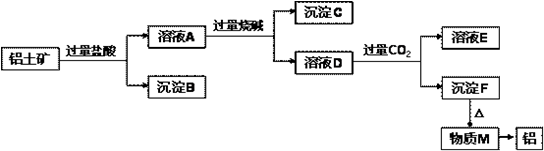
 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图所示,请回答下列问题:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图所示,请回答下列问题: