题目内容
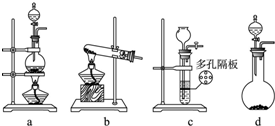
如图是中学化学中常见的实验装置,请根据装置回答问题:
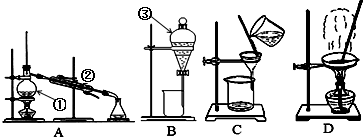
(1)除去自来水中的Cl-等杂质,选择装置: (填代表装置图的字母,下同);
(2)装置②的名称为 ,该装置中加入冷却水时,进水口应该在 (填“上端口或下端口”); 装置③的名称为 .
(3)实验室进行NaCl溶液蒸发时,选择装置: ,实验时一般有以下操作过程 ①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热.其正确的操作顺序为 .

(1)除去自来水中的Cl-等杂质,选择装置:
(2)装置②的名称为
(3)实验室进行NaCl溶液蒸发时,选择装置:
考点:物质的分离、提纯的基本方法选择与应用
专题:实验题
分析:据物质分离的方法有:过滤、分液、蒸发和蒸馏等,根据实验选择合适的仪器以及使用方法.A为蒸馏装置,B为分液装置,C思维过滤装置,D为蒸发装置
(1)水易挥发,且水中可溶性杂质不挥发;
(2)由图可知,A为蒸馏装置,B为分液装置,结合注意事项解答.
(3)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要蒸发水分,使氯化钠成晶体析出;实验时,安装仪器应先下后上,先左后右.
(1)水易挥发,且水中可溶性杂质不挥发;
(2)由图可知,A为蒸馏装置,B为分液装置,结合注意事项解答.
(3)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要蒸发水分,使氯化钠成晶体析出;实验时,安装仪器应先下后上,先左后右.
解答:
解:(1)因蒸馏可以实现水中难挥发性杂质和水的分离,则除去自来水中的Cl─等杂质,可用蒸馏,故答案为:A;
(2)装置A中②的名称是冷凝管,使用时下口进水上口出水,装置③分液漏斗,故答案为:冷凝管;下端口;分液漏斗;
(3)蒸发可以实现易溶于水的固体和水的分离,从氯化钠溶液中得到氯化钠固体可用蒸发,故选D装置;
实验时,安装仪器应先下后上,先左后右,正确顺序为①②③④⑤,故答案为:D;①②③④⑤.
(2)装置A中②的名称是冷凝管,使用时下口进水上口出水,装置③分液漏斗,故答案为:冷凝管;下端口;分液漏斗;
(3)蒸发可以实现易溶于水的固体和水的分离,从氯化钠溶液中得到氯化钠固体可用蒸发,故选D装置;
实验时,安装仪器应先下后上,先左后右,正确顺序为①②③④⑤,故答案为:D;①②③④⑤.
点评:本题考查学生物质分离的方法,熟记不同分离方法的分离原理是解题的关键所在,同时还要掌握仪器的使用方法,难度不大.

练习册系列答案
相关题目
某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校课外兴趣小组以两条途
径分别对X进行如下实验探究.
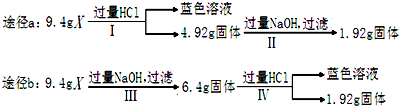
下列有关说法不正确的是( )
径分别对X进行如下实验探究.

下列有关说法不正确的是( )
| A、由Ⅰ可知X中一定存在Fe2O3、Cu | ||
| B、由Ⅱ和Ⅲ可得出结论,混合物中无Al2O3 | ||
| C、1.92g固体为SiO2和Cu的混合物 | ||
D、原混合物中
|
下列存在顺反异构的是( )
| A、乙烯 | B、丙烯 |
| C、2-丁烯 | D、1-丁烯 |