题目内容
17.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )| A. | 由水电离出来的H+的浓度是1.0×10-10 mol/L | |
| B. | 该温度高于25°C | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
分析 A.氢离子抑制了水的电离,溶液中氢氧根离子是水电离的;
B.蒸馏水的pH=6,则c(H+)=c(OH-)=1×10-6 mol•L-1,KW=1×10-12>1×10-14,结合水的电离过程吸热分析;
C.硫酸氢钠电离出的氢离子抑制了水的电离;
D.根据硫酸氢钠溶液中的电荷守恒、物料守恒分析.
解答 解:A.水电离出来的氢离子的浓度等于溶液中氢氧根离子的浓度,c(H+)水=c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1×1{0}^{-12}}{0.01}$mol/L=1×10-10 mol•L-1,故A错误;
B.蒸馏水的pH=6,说明c(H+)=c(OH-)=1×10-6 mol•L-1,KW=1×10-12>1×10-14,说明温度高于25℃,故B正确;
C.NaHSO4晶体溶于蒸馏水中能电离出氢离子,相当于一元强酸,抑制了水的电离,故C正确;
D.根据电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(SO42-),由于c(Na+)=c(SO42-),则c(H+)=c(OH-)+c(SO42-),故D正确;
故选A.
点评 本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,明确水的电离及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,是有利于提高学生的灵活应用能力.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
8.一定条件下,24mL的CO2和N2的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体20mL,则原混合气体中CO2的体积分数为( )
| A. | 33.3% | B. | 44% | C. | 56% | D. | 66.7% |
5.利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
| A. | BaCl2、HCl、品红溶液 | B. | BaCl2、H2SO4、石蕊溶液 | ||
| C. | AgNO3和HNO3溶液 | D. | AgNO3和BaCl2溶液 |
12.把一支充满NO2气体的试管,倒立于盛水的水槽中,充分反应后,下列说法正确的是( )
| A. | 试管中剩余气体约占试管体积的$\frac{1}{2}$ | B. | 试管中剩余气体约占试管体积的$\frac{2}{3}$ | ||
| C. | 剩余气体呈红棕色 | D. | 剩余气体呈无色 |
2.证明一水合氨是弱碱的事实是( )
| A. | 氨水与硫酸发生中和反应速率较慢 | |
| B. | 氨水使酚酞试液变浅红色 | |
| C. | 室温下,测得0.1mol/L,氨水的pH值为11.1 | |
| D. | 氨水易挥发且导电性较差 |
9.在标准状况下,把22.4LNO,NO2的混合气体通入装有1L水的密闭容器中,再向该容器中充入足量的O2,完全反应后(假设反应过程中液体体积不变),容器中所得的溶液的物质的量浓度为( )
| A. | 无法计算 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 1.5mol•L-1 |
7.根据能量变化示意图,下列说法正确的是( )
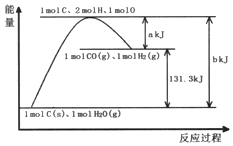

| A. | 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量 | |
| B. | 反应的热化学方程式可表示为C(s)+H2O(g)═CO(g)+H2(g)△H=(a-b)KJ/mol | |
| C. | 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量 | |
| D. | 加入适当的催化剂,可以加快正、逆反应速率 |
