题目内容
7.根据能量变化示意图,下列说法正确的是( )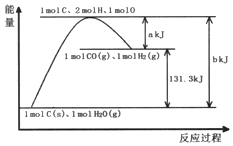
| A. | 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量 | |
| B. | 反应的热化学方程式可表示为C(s)+H2O(g)═CO(g)+H2(g)△H=(a-b)KJ/mol | |
| C. | 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量 | |
| D. | 加入适当的催化剂,可以加快正、逆反应速率 |
分析 由图可知,断裂化学键吸收bkJ能量,形成化学键释放akJ能量,反应物总能量小于生成物子那个能量,为吸热反应,结合催化剂加快反应速率来解答.
解答 解:A.由图可知,1molC(s)和1molH2O(g)反应生成1molCO(g)和1molH2(g)一定吸收131.3kJ的热量,若水为液体时大于131.3kJ,故A错误;
B.为吸热反应,反应的热化学方程式可表示为C(s)+H2O(g)═CO(g)+H2(g)△H=(b-a)KJ/mol,故B错误;
C.为吸热反应,则反应物断键吸收的能量大于生成物成键放出的能量,故C错误;
D.正催化剂改变反应的途径,降低反应所需的活化能,则加入适当的催化剂,可以加快正、逆反应速率,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、物质的状态为解答的关键,侧重分析与应用能力的考查,注意图象的应用,题目难度不大.

练习册系列答案
相关题目
17.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )
| A. | 由水电离出来的H+的浓度是1.0×10-10 mol/L | |
| B. | 该温度高于25°C | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
18.已知①中国古代四大发明之一的黑火药,它是由硫磺、木炭粉和硝石组成;②油条中铝含量超标十分普遍,是影响人们健康的食品安全隐患.油条无铝配方由碳酸氢钠(小苏打)和臭粉组成.下列关于硝石和臭粉的成份组合正确的是( )
| A. | KNO3、NH4HCO3 | B. | KNO3、Na2CO3 | C. | HNO3、(NH4)2CO3 | D. | NH4NO3、Na2CO3 |
15.下列表示正确的是( )
| A. | 含20个电子的氯原子的符号为:3517Cl | |
| B. | 四氯化碳的球棍模型: | |
| C. | 氩的原子结构示意图: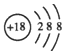 | |
| D. | 乙烯的结构简式:CH2CH2 |
2.X、Y、Z、W四种短周期主族元素,其中W是非金属性最强的元素,它们在周期表中位置如表所示,下列说法不正确的是( )
| X | Y | W | |
| Z |
| A. | 四种元素的单质中,W的氧化性最强 | |
| B. | Z元素的气态氢化物稳定性比W强 | |
| C. | Y元素的氧化物对应水化物的酸性一定比Z弱 | |
| D. | X、Z元素能形成化学式为XZ2的化合物 |
12.下列各图与表述一致的是( )
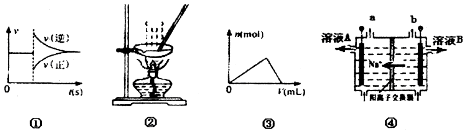

| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 曲线图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧饭化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
19.下列关于实验的说法正确的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 分离Fe(OH)3胶体和FeCl3溶液 | 将混合液倒入过滤器中过滤 |
| B | 证明Ksp(CuS)<Ksp(ZnS) | 向10mL0.1mol/LNa2S溶液中滴入几滴0.1mol/L ZnCl2溶液,产生白色沉淀,再加入CuSO4溶液,产生黑色沉淀 |
| C | 证明酸性:H2CO3>H3BO3 | 向Na2CO3中滴入过量H3BO3溶液,无气泡冒出 |
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没,产生气泡 |
| A. | A | B. | B | C. | C | D. | D |
6.下列关于化工生产原理的叙述中,符合当前工业生产实际的是( )
| A. | 氯碱工业中,氢氧化钠在电解槽的阳极区产生 | |
| B. | 硫酸工业中,二氧化硫催化氧化使用催化剂,可增加二氧化硫的转化率 | |
| C. | 合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率 | |
| D. | 接触法制硫酸中三氧化硫用水吸收制成浓硫酸 |