题目内容
9.在标准状况下,把22.4LNO,NO2的混合气体通入装有1L水的密闭容器中,再向该容器中充入足量的O2,完全反应后(假设反应过程中液体体积不变),容器中所得的溶液的物质的量浓度为( )| A. | 无法计算 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 1.5mol•L-1 |
分析 发生4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3,气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,结合N原子守恒生成硝酸为1mol,结合c=$\frac{n}{V}$计算.
解答 解:气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,由N原子守恒生成硝酸为1mol,假设反应过程中液体体积不变,即溶液的体积为1L,容器中所得的溶液的物质的量浓度为$\frac{1mol}{1L}$=1mol/L,
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握N原子守恒判断硝酸的物质的量为解答的关键,侧重分析与计算能力的考查,注意发生的反应,题目难度不大.

练习册系列答案
相关题目
7.等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |
20.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 体系的压强不再发生变化 | |
| B. | 混合气体的平均相对分子质量不再发生变化 | |
| C. | v正(CO)=v逆(H2O) | |
| D. | 1 mol H-H键断裂的同时断裂2 mol H-O键 |
17.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )
| A. | 由水电离出来的H+的浓度是1.0×10-10 mol/L | |
| B. | 该温度高于25°C | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
4.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
| A. | lmolKClO3参加反应生成气体的体积为22.4L(标况下) | |
| B. | 该反应的还原产物为CO2 | |
| C. | 0.5mol H2C2O4参加反应有lmol电子转移 | |
| D. | H2SO4在反应中是氧化剂 |
14.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 食盐、醋、糖都有防腐功效 | |
| B. | 煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性 | |
| C. | 鸡蛋煮熟后,蛋白质水解成了氨基酸 | |
| D. | 月饼包装中的还原铁粉小包和旺旺仙贝包装中的生石灰小包的作用相同 |
18.已知①中国古代四大发明之一的黑火药,它是由硫磺、木炭粉和硝石组成;②油条中铝含量超标十分普遍,是影响人们健康的食品安全隐患.油条无铝配方由碳酸氢钠(小苏打)和臭粉组成.下列关于硝石和臭粉的成份组合正确的是( )
| A. | KNO3、NH4HCO3 | B. | KNO3、Na2CO3 | C. | HNO3、(NH4)2CO3 | D. | NH4NO3、Na2CO3 |
19.下列关于实验的说法正确的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 分离Fe(OH)3胶体和FeCl3溶液 | 将混合液倒入过滤器中过滤 |
| B | 证明Ksp(CuS)<Ksp(ZnS) | 向10mL0.1mol/LNa2S溶液中滴入几滴0.1mol/L ZnCl2溶液,产生白色沉淀,再加入CuSO4溶液,产生黑色沉淀 |
| C | 证明酸性:H2CO3>H3BO3 | 向Na2CO3中滴入过量H3BO3溶液,无气泡冒出 |
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没,产生气泡 |
| A. | A | B. | B | C. | C | D. | D |
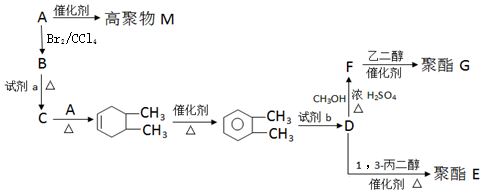
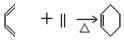
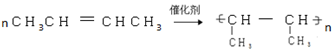 ②B→C
②B→C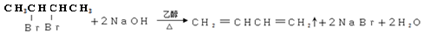
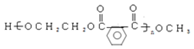 .
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)