题目内容
合金是建造航空母舰的主体材料.如:航母舰体可由合金钢制造,航母升降机可由铝合金制造;航母螺旋桨主要用铜合金制造.
(1)Al原子核外电子占据 个纺锤形轨道;Fe原子核外电子排布式为1S22S22P63S23p63d64S2,铁原子核外有 种能量不同的电子.
(2)下列事实可用作比较Al和Fe金属性强弱依据的是…
A.Al的导电性、导热性比Fe更好
B.Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液
C.相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D.在野外利用铝热剂焊接铁轨.
(3)航母在海洋中行驶时,舰体发生的电化学腐蚀类型为: ,其中正极发生的电极反应式为: .
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为 .
(5)Al-Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为: .
(6)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应.下列叙述正确的是
A.Mg作负极,Al作正极
B.该反应速率比纯铝与NaOH溶液的反应速率快
C.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
D.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少
.
(1)Al原子核外电子占据
(2)下列事实可用作比较Al和Fe金属性强弱依据的是…
A.Al的导电性、导热性比Fe更好
B.Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液
C.相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D.在野外利用铝热剂焊接铁轨.
(3)航母在海洋中行驶时,舰体发生的电化学腐蚀类型为:
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为
(5)Al-Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为:
(6)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应.下列叙述正确的是
A.Mg作负极,Al作正极
B.该反应速率比纯铝与NaOH溶液的反应速率快
C.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
D.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少
| 2 |
| 3 |
考点:铝的化学性质,金属在元素周期表中的位置及其性质递变的规律,原子核外电子排布,金属的电化学腐蚀与防护
专题:原子组成与结构专题,电化学专题,几种重要的金属及其化合物
分析:(1)Al原子核外电子纺锤形轨道有2p、3p轨道;
Fe原子核外电子排布式为1S22S22P63S23p63d64S2,能级不同电子能量不同;
(2)金属性强弱的判断方法有:金属之间的置换反应、金属与酸反应的难易程度、金属对应氧化物的水化物碱性强弱等;
(3)中性或弱酸性条件下钢铁发生吸氧腐蚀;
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,得到的固体是氧化铜,氧化铜中铜的质量分数就等于合金中Cu的质量分数;
(5)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(6)A.易失电子的金属作负极;
B.原电池加快负极金属的腐蚀;
C.转移电子相等,生成氢气的物质的量相等;
D.若加入的是20mL 1mol/L的盐酸,则镁失电子生成氢气.
Fe原子核外电子排布式为1S22S22P63S23p63d64S2,能级不同电子能量不同;
(2)金属性强弱的判断方法有:金属之间的置换反应、金属与酸反应的难易程度、金属对应氧化物的水化物碱性强弱等;
(3)中性或弱酸性条件下钢铁发生吸氧腐蚀;
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,得到的固体是氧化铜,氧化铜中铜的质量分数就等于合金中Cu的质量分数;
(5)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(6)A.易失电子的金属作负极;
B.原电池加快负极金属的腐蚀;
C.转移电子相等,生成氢气的物质的量相等;
D.若加入的是20mL 1mol/L的盐酸,则镁失电子生成氢气.
解答:
解:(1)Al原子核外电子纺锤形轨道有2p、3p轨道,Al原子核外电子占据2p、3p轨道数为4;
Fe原子核外电子排布式为1S22S22P63S23p63d64S2,能级不同电子能量不同,铁原子含有7种能级,所以有7种能量不同的电子;
故答案为:4;7种;
(2)A.Al的导电性、导热性比Fe更好,不能说明Al、Fe失电子难易程度,所以不能说明Al的金属性大于Fe,故错误;
B.Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液,不能说明Al、Fe失电子难易程度,不能说明Al的金属性大于Fe,故B错误;
C.相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多,金属的活动性与失电子多少无关,所以不能说明 Al的活动性大于Fe,故C错误;
D.在野外利用铝热剂焊接铁轨,铝置换出铁,说明铝的还原性大于铁,所以铝的活动性大于铁,故D正确;
故选D;
(3)钢铁在海水中发生吸热反应,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:吸氧腐蚀;O2+2H2O+4e-=4OH-;
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,得到的固体是氧化铜,氧化铜中铜的质量分数就等于合金中Cu的质量分数,所以合金中铜的质量分数=
×100%=80%,故答案为:80%;
(5)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(6)A.该装置中,Mg作正极,Al作负极,故错误;
B.原电池加快负极金属的腐蚀,所以该反应速率比纯铝与NaOH溶液的反应速率快,故正确;
C.若把NaOH中的H换成D(D为重氢),转移电子相等,所以生成的氢气中D与H物质的量之比为1:1,故错误;
D.Al和NaOH反应生成氢气的物质的量=
×3=0.03mol,
若加入的是20mL 1mol/L的盐酸,镁、铝和稀盐酸反应时,稀盐酸不足量,根据H原子守恒得n(H2)=
×n(HCl)=
×1mol/L×0.02L=0.01mol,所以放出的氢气的物质的量减少
,故正确;
故选BD.
Fe原子核外电子排布式为1S22S22P63S23p63d64S2,能级不同电子能量不同,铁原子含有7种能级,所以有7种能量不同的电子;
故答案为:4;7种;
(2)A.Al的导电性、导热性比Fe更好,不能说明Al、Fe失电子难易程度,所以不能说明Al的金属性大于Fe,故错误;
B.Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液,不能说明Al、Fe失电子难易程度,不能说明Al的金属性大于Fe,故B错误;
C.相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多,金属的活动性与失电子多少无关,所以不能说明 Al的活动性大于Fe,故C错误;
D.在野外利用铝热剂焊接铁轨,铝置换出铁,说明铝的还原性大于铁,所以铝的活动性大于铁,故D正确;
故选D;
(3)钢铁在海水中发生吸热反应,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:吸氧腐蚀;O2+2H2O+4e-=4OH-;
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,得到的固体是氧化铜,氧化铜中铜的质量分数就等于合金中Cu的质量分数,所以合金中铜的质量分数=
| 64 |
| 64+16 |
(5)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(6)A.该装置中,Mg作正极,Al作负极,故错误;
B.原电池加快负极金属的腐蚀,所以该反应速率比纯铝与NaOH溶液的反应速率快,故正确;
C.若把NaOH中的H换成D(D为重氢),转移电子相等,所以生成的氢气中D与H物质的量之比为1:1,故错误;
D.Al和NaOH反应生成氢气的物质的量=
| 1mol/L×0.02L |
| 2 |
若加入的是20mL 1mol/L的盐酸,镁、铝和稀盐酸反应时,稀盐酸不足量,根据H原子守恒得n(H2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 2 |
| 3 |
故选BD.
点评:本题以铝及其化合物为载体考查了原电池原理、核外电子排布、金属活动性强弱的判断等知识点,根据物质间的反应、原电池中各个电极上发生的反应等知识点来分析解答,注意:金属活动性强弱与金属失电子难易程度有关,与失电子多少无关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应属于氧化还原反应的是:( )
A、CaCO3
| ||||
| B、CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||||
C、CuO+CO
| ||||
| D、CuO+H2SO4═CuSO4+H2O |
 图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )| A、导线上的电流方向为A→B |
| B、A中SO42-浓度有所减小 |
| C、盐桥中Cl-向A中移动 |
| D、B中铜片质量有所增加 |
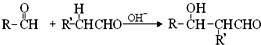 (-R、-R’表示氢原子或烃基)
(-R、-R’表示氢原子或烃基)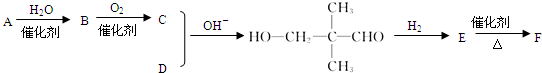
 有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为
有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为