题目内容
某些物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,它在G的浓溶液中发生钝化,F的溶液中只含一种溶质.(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明).
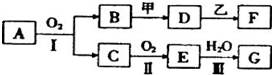
(1)若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性.则:
①E为 色气体;
②B与甲反应的化学方程式是 ;
③D与乙反应的离子方程式是 ;
(2)若B为红棕色固体,C是能使品红试液褪色的气体,乙为长周期金属,反应I化工生产中的重要反应,D的水溶液中加人HNO3酸化的AgN03溶液有白色沉淀生成.则:
①甲的化学式为 ;
②D的水溶液常用于制作印刷电路板,该反应的离子方程式为 .

(1)若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性.则:
①E为
②B与甲反应的化学方程式是
③D与乙反应的离子方程式是
(2)若B为红棕色固体,C是能使品红试液褪色的气体,乙为长周期金属,反应I化工生产中的重要反应,D的水溶液中加人HNO3酸化的AgN03溶液有白色沉淀生成.则:
①甲的化学式为
②D的水溶液常用于制作印刷电路板,该反应的离子方程式为
考点:无机物的推断
专题:推断题
分析:(1)用两根玻璃棒分别蘸取A和G的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知A为NH3,则C为NO,E为NO2,G为HNO3,B为H2O.甲为一种淡黄色固体,与水反应生成D,D的溶液呈碱性,可推知甲为Na2O2,D为NaOH,乙为金属单质,常温下,它在浓硝酸中发生钝化,且与NaOH溶液反应生成F,F的溶液呈碱性,则乙为Al、F为NaAlO2;
(2)若B为红棕色固体,C是能使品红试液褪色的气体,则B为Fe2O3,C为SO2,反应I是化工生产中的重要反应,可推知A为FeS2,结合转化关系可推知,E为SO3,G为H2SO4.甲由两种单质直接化合得到,与氧化铁反应生成D,D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2.
(2)若B为红棕色固体,C是能使品红试液褪色的气体,则B为Fe2O3,C为SO2,反应I是化工生产中的重要反应,可推知A为FeS2,结合转化关系可推知,E为SO3,G为H2SO4.甲由两种单质直接化合得到,与氧化铁反应生成D,D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2.
解答:
解:(1)用两根玻璃棒分别蘸取A和G的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知A为NH3,则C为NO,E为NO2,G为HNO3,B为H2O.甲为一种淡黄色固体,与水反应生成D,D的溶液呈碱性,可推知甲为Na2O2,D为NaOH,乙为金属单质,常温下,它在浓硝酸中发生钝化,且与NaOH溶液反应生成F,F的溶液呈碱性,则乙为Al、F为NaAlO2,则:
①E是NO2,为红棕色气体,故答案为:红棕;
②B与甲反应的化学方程式是:2H2O+2Na2O2=4NaOH+O2↑,故答案为:2H2O+2Na2O2=4NaOH+O2↑;
③D与乙反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=AlO2-+3H2↑;
(2)若B为红棕色固体,C是能使品红试液褪色的气体,则B为Fe2O3,C为SO2,反应I是化工生产中的重要反应,可推知A为FeS2,结合转化关系可推知,E为SO3,G为H2SO4.甲由两种单质直接化合得到,与氧化铁反应生成D,D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2,则:
①甲的化学式为HCl,故答案为:HCl;
②FeCl3水溶液常用于制作印刷电路板,该反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+.
①E是NO2,为红棕色气体,故答案为:红棕;
②B与甲反应的化学方程式是:2H2O+2Na2O2=4NaOH+O2↑,故答案为:2H2O+2Na2O2=4NaOH+O2↑;
③D与乙反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=AlO2-+3H2↑;
(2)若B为红棕色固体,C是能使品红试液褪色的气体,则B为Fe2O3,C为SO2,反应I是化工生产中的重要反应,可推知A为FeS2,结合转化关系可推知,E为SO3,G为H2SO4.甲由两种单质直接化合得到,与氧化铁反应生成D,D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2,则:
①甲的化学式为HCl,故答案为:HCl;
②FeCl3水溶液常用于制作印刷电路板,该反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+.
点评:本题考查无机物的推断,物质的颜色、特殊性质、反应现象为推断的突破口,侧重于学生分析能力与元素化合物知识的考查,难度中等.

练习册系列答案
相关题目
一些科学家采用高质子导电性的SCY陶瓷(能传递H+),利用电解原理实现了氨的电化学合成,该过程N2和H2的转化率远高于现在工业上使用的氨合成法.对于电化学化合氨的有关叙述正确的是( )
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、负极的电极反应式:N2+6e-+6H+═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
对于下面的反应 14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A、氧化剂只有CuSO4 |
| B、Cu2S 既是氧化剂又是还原剂 |
| C、被氧化的硫与被还原的硫的质量比为3:7 |
| D、14mol CuSO4可氧化5mol FeS2 |
判断食物的酸碱性,是根据食物进入人体后所生成的最终代谢物的酸碱性而定.含氮、磷等非金属元素较多食物,为酸性食物;含钠、钾、钙、镁等金属元素食物较多,为碱性食物.对食物的酸、碱性判断正确的是
( )
( )
| A、苹果是酸性食物 |
| B、猪肉、牛肉是碱性食物 |
| C、大米、面包是碱性食物 |
| D、巧克力、奶油是酸性食物 |