题目内容
某温度(t℃)时,水的离子积为Kw=1×10-13.若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比.
(1)若所得混合溶液为中性,则a:b= ;此溶液中各种离子的浓度由大到小的排列顺序是 .
(2)若所得混合溶液的pH=2,则a:b= .
(1)若所得混合溶液为中性,则a:b=
(2)若所得混合溶液的pH=2,则a:b=
考点:酸碱混合时的定性判断及有关ph的计算,水的电离
专题:电离平衡与溶液的pH专题
分析:若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
①溶液呈中性,说明酸和碱恰好完全反应,根据溶液的酸碱性及电荷守恒确定离子浓度大小;
②若所得混合液的pH=2,根据c(H+)=
计算酸碱的体积比,根据溶液的酸碱性及物料守恒判断离子浓度大小.
| 10-13 |
| 10-11 |
①溶液呈中性,说明酸和碱恰好完全反应,根据溶液的酸碱性及电荷守恒确定离子浓度大小;
②若所得混合液的pH=2,根据c(H+)=
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
解答:
解:若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则
①若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)>c(SO4 2- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO4 2-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO4 2- )>c(H+)=c(OH-);
②若所得混合液的pH=2,则有
=0.01,解得:a:b=9:2,
故答案为:9:2;
| 10-13 |
| 10-11 |
①若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)>c(SO4 2- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO4 2-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO4 2- )>c(H+)=c(OH-);
②若所得混合液的pH=2,则有
| 0.1b-0.01a |
| a+b |
故答案为:9:2;
点评:本题考查酸碱混合的定性判断,会根据溶液的酸碱性及电荷守恒判断离子浓度大小,注意(2)中水的离子积常数是10-13而不是10-14,否则会导致错误,为易错点.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、分子组成相差一个或若干个CH2的有机物互称为同系物 |
| B、分子式相同而结构不同的有机物必定是同分异构体 |
| C、若A与B互为同系物,则A、B必符合同一个通式 |
| D、同系物之间不可能是同分异构体 |
已知NA代表阿伏加德罗常数,下列说法正确的是( )
| A、34 g H2O2中含有的阴离子数为NA |
| B、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C、1mol重甲基(-CD3)含有电子数为9NA |
| D、1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA |
 化学学科中存在以下四种平衡体系:化学平衡、电离平衡、水解平衡和溶解平衡,且均符合勒夏特列原理.请回答下列问题:
化学学科中存在以下四种平衡体系:化学平衡、电离平衡、水解平衡和溶解平衡,且均符合勒夏特列原理.请回答下列问题: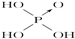
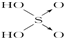

 )在催化剂作用下发生缩聚反应生成聚乳酸:
)在催化剂作用下发生缩聚反应生成聚乳酸: