题目内容
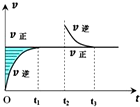 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:A.由于正反应速率不随反应时间和压强的改变而改变,故Z和W都是不是气体;
B.根据图象可知,只有X是气体,Y可以是气体或不是气体,所以反应过程中气体的摩尔质量始终不变或不等;
C.化学平衡常数只与温度有关,该温度下平衡常数的表达式K=c(X)是定值,则t1~t2时间段与t3时刻后的c(X)相等;
D.该反应在温度为T0以上时才能自发进行,根据△H-T△S<0,得出该反应是吸热反应,升高温度平衡正向移动,平衡常数增大;
B.根据图象可知,只有X是气体,Y可以是气体或不是气体,所以反应过程中气体的摩尔质量始终不变或不等;
C.化学平衡常数只与温度有关,该温度下平衡常数的表达式K=c(X)是定值,则t1~t2时间段与t3时刻后的c(X)相等;
D.该反应在温度为T0以上时才能自发进行,根据△H-T△S<0,得出该反应是吸热反应,升高温度平衡正向移动,平衡常数增大;
解答:
解:A.根据图象可知,正反应速率不随反应时间和压强的改变而改变,故Z和W都是不是气体,故A正确;
B.结合图象可知,X是气体,Y可能不是气体或是气体,反应过程中气体的摩尔质量始终不变,或不相同,所以两时间段反应体系中气体的平均摩尔质量可能相等也可能不等,故B错误;
C.由于化学平衡常数只与温度有关,该温度下平衡常数的表达式K=c(X)是定值,则t1~t2时间段与t3时刻后的c(X)相等,故C正确;
D.由于该反应在温度为T以上时才能自发进行,根据△H-T△S<0,得出该反应是吸热反应,升高温度平衡正向移动,平衡常数增大,故D正确;
故选B.
B.结合图象可知,X是气体,Y可能不是气体或是气体,反应过程中气体的摩尔质量始终不变,或不相同,所以两时间段反应体系中气体的平均摩尔质量可能相等也可能不等,故B错误;
C.由于化学平衡常数只与温度有关,该温度下平衡常数的表达式K=c(X)是定值,则t1~t2时间段与t3时刻后的c(X)相等,故C正确;
D.由于该反应在温度为T以上时才能自发进行,根据△H-T△S<0,得出该反应是吸热反应,升高温度平衡正向移动,平衡常数增大,故D正确;
故选B.
点评:本题考查化学平衡有关计算、化学平衡图象等,判断t2时刻改变条件是关键,本题难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①过量Na2O2投入到FeCl2溶液中
②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④Na2SiO3溶液中通入过量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2.
①过量Na2O2投入到FeCl2溶液中
②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④Na2SiO3溶液中通入过量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2.
| A、全部 | B、①⑤ |
| C、②③④ | D、②③④⑤ |
下列说法不正确的是( )
| A、分子组成相差一个或若干个CH2的有机物互称为同系物 |
| B、分子式相同而结构不同的有机物必定是同分异构体 |
| C、若A与B互为同系物,则A、B必符合同一个通式 |
| D、同系物之间不可能是同分异构体 |
我国最新报道的高温超导体中,铊是组成成分之一,已知铊与铝是同主族元素.关于铊的判断有错误的是( )
| A、铊是质软的银白色的金属 |
| B、氢氧化铊是两性氢氧化物 |
| C、铊能置换出盐酸中的氢 |
| D、铊能与氧气发生反应 |
下列叙述正确的是( )
| A、标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl-、NO3- |
| D、从C(石墨)═C(金刚石);△H=+1.9kJ?mol-1,可知金刚石比石墨更稳定 |
下列条件下,两瓶气体所含的原子数一定相等的是( )
| A、同体积、同密度的CO和CO2气体 |
| B、同温度、同体积的O2和O3气体 |
| C、同压强、同体积的N2O和CO2气体 |
| D、同质量、不同密度的O2和O3 气体 |
已知NA代表阿伏加德罗常数,下列说法正确的是( )
| A、34 g H2O2中含有的阴离子数为NA |
| B、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C、1mol重甲基(-CD3)含有电子数为9NA |
| D、1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA |