题目内容
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式 .
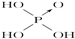
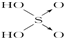
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为 ,SO2-4的立体构型是 ,其中S原子的杂化轨道类型是 .
(3)N、O、F三种元素的电负性由大到小的顺序为 ,Cu2O的熔点高于Cu2S,请解释原因 .
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为 .
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm.又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为 [列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6].
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为
(3)N、O、F三种元素的电负性由大到小的顺序为
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm.又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断,铜金属及其重要化合物的主要性质
专题:化学键与晶体结构
分析:(1)锡与碳是同主族元素,所以价电子数相同,是第五周期元素,价电子排布在5s5p轨道上;
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出[Cu(NH3)4]SO4?H2O晶体,阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;根据价层电子对互斥理论确定离子的立体构型,通过中心原子的价电子对数的计算确定原子的杂化方式;
(3)在同一周期从左到右电负性递增,离子晶体中离子半径越小,晶格能越大,熔点越高,据此答题;
(4)氨水、过氧化氢和铜单独不反应,而同时混合能反应,说明两者能互相促进,这是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,根据电荷守恒,还有氢氧根离子生成;
(5)根据铜摩尔质量=摩尔体积×密度计算.
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出[Cu(NH3)4]SO4?H2O晶体,阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;根据价层电子对互斥理论确定离子的立体构型,通过中心原子的价电子对数的计算确定原子的杂化方式;
(3)在同一周期从左到右电负性递增,离子晶体中离子半径越小,晶格能越大,熔点越高,据此答题;
(4)氨水、过氧化氢和铜单独不反应,而同时混合能反应,说明两者能互相促进,这是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,根据电荷守恒,还有氢氧根离子生成;
(5)根据铜摩尔质量=摩尔体积×密度计算.
解答:
解:(1)锡与碳是同主族元素,所以价电子数相同,是第五周期元素,价电子排布在5s5p轨道上,价电子排布式为5s25p2,故答案为:5s25p2;
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出[Cu(NH3)4]SO4?H2O晶体,[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键;SO2-4中硫原子的价电子对数为
=4,无孤对电子,所以S原子的杂化轨道类型sp3杂化,SO2-4的立体构型是正四面体,
故答案为:共价键、离子键、配位键;正四面体;sp3杂化;
(3)在同一周期从左到右电负性递增,所以N、O、F三种元素的电负性由大到小的顺序为F>O>N;离子晶体中离子半径越小,晶格能越大,熔点越高,Cu2O和Cu2S为离子晶体,氧离子的半径小于硫离子,所以Cu2O中阴阳离子的核间距小于Cu2S,所以晶格能大,所以熔点高,
故答案为:F>O>N;Cu2O和Cu2S为离子晶体,氧离子的半径小于硫离子,所以Cu2O中阴阳离子的核间距小于Cu2S,所以晶格能大,所以熔点高;
(4)氨水、过氧化氢和铜单独不反应,而同时混合能反应,说明两者能互相促进,是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3═[Cu(NH3)4](OH)2,故答案为:Cu+H2O2+4NH3═[Cu(NH3)4](OH)2;
(5)铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子;1pm=10-10cm,故一个晶胞的体积为(361×10-10)3=4.7×10-23cm3;
晶胞的质量=体积×密度,一个晶胞的质量为4.7×10-23cm3×9.00g?cm-3=4.23×10-22g;
在一个体心晶胞含4个铜原子,故铜的摩尔质量=
×晶胞质量×NA,由Ar(Cu)=63.6g?mol-1×NA,得NA=6.01×1023mol-1,
故答案为:6.01×1023mol-1.
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出[Cu(NH3)4]SO4?H2O晶体,[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键;SO2-4中硫原子的价电子对数为
| 6+2 |
| 2 |
故答案为:共价键、离子键、配位键;正四面体;sp3杂化;
(3)在同一周期从左到右电负性递增,所以N、O、F三种元素的电负性由大到小的顺序为F>O>N;离子晶体中离子半径越小,晶格能越大,熔点越高,Cu2O和Cu2S为离子晶体,氧离子的半径小于硫离子,所以Cu2O中阴阳离子的核间距小于Cu2S,所以晶格能大,所以熔点高,
故答案为:F>O>N;Cu2O和Cu2S为离子晶体,氧离子的半径小于硫离子,所以Cu2O中阴阳离子的核间距小于Cu2S,所以晶格能大,所以熔点高;
(4)氨水、过氧化氢和铜单独不反应,而同时混合能反应,说明两者能互相促进,是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3═[Cu(NH3)4](OH)2,故答案为:Cu+H2O2+4NH3═[Cu(NH3)4](OH)2;
(5)铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子;1pm=10-10cm,故一个晶胞的体积为(361×10-10)3=4.7×10-23cm3;
晶胞的质量=体积×密度,一个晶胞的质量为4.7×10-23cm3×9.00g?cm-3=4.23×10-22g;
在一个体心晶胞含4个铜原子,故铜的摩尔质量=
| 1 |
| 4 |
故答案为:6.01×1023mol-1.
点评:本题主要考查了原子核外电子排布、配合物的结构、晶体的性质、晶胞的计算等知识,综合性较强,中等难度.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、大理石与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B、钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| C、铁与稀硫酸的反应:Fe+2H+=Fe2++H2↑ |
| D、Ba(OH)2溶液与H2SO4溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
下列条件下,两瓶气体所含的原子数一定相等的是( )
| A、同体积、同密度的CO和CO2气体 |
| B、同温度、同体积的O2和O3气体 |
| C、同压强、同体积的N2O和CO2气体 |
| D、同质量、不同密度的O2和O3 气体 |
 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: