题目内容
14.下列说法不正确的是( )| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | NaH的存在能支持可将氢元素放在ⅦA的观点 | |
| D. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 |
分析 A.同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小;非金属性越强,电负性越大,金属性越强,电负性越小;
B.金属的电负性一般小于1.8,非金属的电负性一般大于1.8;
C.NaH中的H元素最低为-1,ⅦA族中元素的最低化合价为-1价;
D.氢原子中只有一个电子,但不是只有一个轨道.
解答 解:A.ⅠA元素的电负性从上到下,非金属性减弱,金属性增强,所以电负性从上到下逐渐减小,Ⅶ元素的第一电离能从上到下逐渐减小,故A正确;
B.金属的电负性一般小于1.8,非金属的电负性一般大于1.8,所以电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度,故B正确;
C.NaH中的H元素最低为-1,可以放在放在ⅦA族中,故C正确;
D.氢原子中有一个电子,但轨道是人们规定的,只是空轨道而已,氢原子不只有一个轨道,故D错误;
故选D.
点评 本题考查元素电离能、电负性变化规律,明确电离能与失电子难易程度、电负性与得电子强弱关系是解本题关键,侧重考查运用知识解答问题能力,熟练掌握元素周期律知识,题目难度不大.

练习册系列答案
相关题目
4.用0.1000mol/L的盐酸测定某NaOH溶液的物质的量浓度.试回答:
(1)用碱式滴定管量取20.00mL待测液,将其移至锥形瓶中,再滴入酚酞;
(2)用0.1000mol/L标准盐酸滴定NaOH溶液,滴定时两眼应注视锥形瓶中溶液颜色变化直到滴定终点;
(3)以下操作中能导致所测定NaOH溶液浓度偏低的是(注意:错选、多选倒扣分)BC;
A.酸式滴定管未用标准溶液润洗
B.摇动锥形瓶时,有液滴飞溅出来
C.读取盐酸的体积时,滴定前平视读数,滴定后俯视读数
(4)某同学滴定时记录的数据如下:
三次滴定消耗盐酸体积的平均值为22.40mL,待测NaOH溶液的浓度为0.112mol/L.
(1)用碱式滴定管量取20.00mL待测液,将其移至锥形瓶中,再滴入酚酞;
(2)用0.1000mol/L标准盐酸滴定NaOH溶液,滴定时两眼应注视锥形瓶中溶液颜色变化直到滴定终点;
(3)以下操作中能导致所测定NaOH溶液浓度偏低的是(注意:错选、多选倒扣分)BC;
A.酸式滴定管未用标准溶液润洗
B.摇动锥形瓶时,有液滴飞溅出来
C.读取盐酸的体积时,滴定前平视读数,滴定后俯视读数
(4)某同学滴定时记录的数据如下:
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定完成时,消耗盐酸的体积/mL |
| 1 | 20.00 | 22.40 |
| 2 | 20.00 | 22.42 |
| 3 | 20.00 | 22.38 |
5.一氧化钴(CoO)是一种重要的工业催化剂,某学习小组欲从含钴废料中(含Co2O3、CoO 和少量Fe、Al)回收一氧化钴,设计工艺流程如下:已知:Co2O3的氧化性>Cl2的氧化性下列说法不正确的是( )
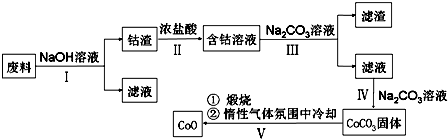

| A. | 第Ⅰ步反应后得到的滤液主要是含铝溶液 | |
| B. | 第Ⅱ步中盐酸表现出酸性、还原性,且必须过量 | |
| C. | 第Ⅲ步中Na2CO3主要作用是使Fe3+沉淀,滤渣主要为Fe(OH)3 | |
| D. | 第Ⅳ步操作为过滤,第Ⅴ步煅烧后,也可以在一氧化碳气体氛围中冷却 |
2.下列物质中,含有共价键的离子化合物的是( )
| A. | MgCl2 | B. | HCl | C. | H2O | D. | NaOH |
9.下列叙述正确的是( )
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
19.下列溶液不能区别SO2和CO2气体的( )
| A. | 稀盐酸 | B. | 品红溶液 | C. | 酸性高锰酸钾 | D. | 溴水 |
6.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
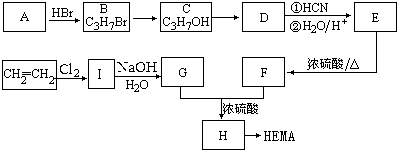
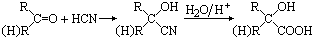
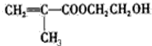 甲基丙烯酸羟乙酯
甲基丙烯酸羟乙酯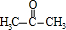 +2H2O.
+2H2O. .
.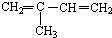 与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br.
与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br. .
.