题目内容
10.铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域.由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图1: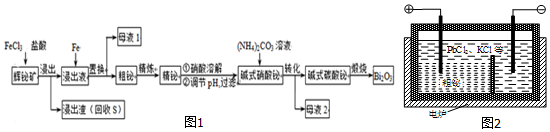
回答下列问题:
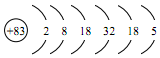
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为
 .
.(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是Bi3++H2O+Cl-=BiOCl+2H+(用离子方程式表示).
(3)“置换”时生成单质铋的离子方程式为2Bi3++3Fe=3Fe2++2Bi.“母液1”中通入气体X后可循环利用,气体X的化学式为Cl2.
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如图2.电解后,阳极底部留下的为精铋.写出电极反应式:阳极Pb-2e-=Pb2+;阴极Pb2++2e-=Pb.
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是没有污染性气体生成.“母液2”中可回收的主要物质是NH4NO3.
分析 辉铋矿(主要成分是Bi2S3.还含PbO2杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质:Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为S,滤液中含有Bi3+,H+,Pb2+,滤液中加入铁粉过滤得到粗铋:2Bi3++3Fe=3Fe2++2Bi,和母液1主要是氯化亚铁,“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼除去Pb,得到精铋,加入硝酸溶解调节pH得到碱式硝酸铋,与碳酸铵溶液反应得到碱式碳酸铋,母液2为硝酸铵,将碱式碳酸铋煅烧生成Bi2O3,据此分析作答.
解答 解:Bi位于元素周期表第六周期,与N、P同族,根据核外电子排布规律Bi的原子外层有6层,最外层排布5个电子,结构示意图为: ;
;
故答案为: ;
;
(2)“浸出”时Bi2S3与FeCl3溶液反应,铁离子有氧化性,氧化硫离子为硫单质,反应为:Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S;反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,反应为:Bi3++H2O+Cl-=BiOCl+2H+;
故答案为:Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S;Bi3++H2O+Cl-=BiOCl+2H+;
(3)置换时铁将Bi3+还原为Bi,自身生成亚铁离子,2Bi3++3Fe=3Fe2++2Bi;母液1主要是氯化亚铁,通入氯气生成氯化铁,可循环使用;
故答案为:2Bi3++3Fe=3Fe2++2Bi;Cl2;
(4)粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,电解液为氯化铅、氯化钾,阳极为Pb发生氧化反应,反应为:Pb-2e-=Pb2+,阴极为电解液中的铅离子发生还原反应,反应式为:Pb2++2e-=Pb;
故答案为:Pb-2e-=Pb2+;Pb2++2e-=Pb;
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,可以改良产品性状,且没有污染性的气体产生;母液2为硝酸铵,可回收;
故答案为:没有污染性气体生成;NH4NO3.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、电解精炼金属的原理等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

①胶体的吸附 ②盐类水解 ③焰色反应 ④氧化还原反应.
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
| A. | 白色固体一定只含有硫酸铵 | |
| B. | 若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况) | |
| C. | 从上述数据能求算出白色固体中(NH4)2SO4、NH4HSO4的物质的量之比为1:2 | |
| D. | 将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵盐 |
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化.
资料b:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
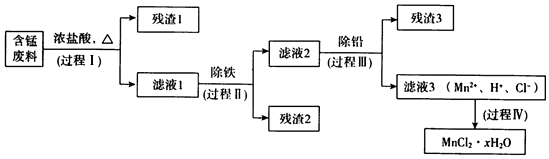
(1)过程I的目的是浸出锰.经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+.
①MnO2与浓盐酸反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红.
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=4Fe3++2H2O
c.…
写出c的离子方程式:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O.
(2)过程Ⅱ的目的是除铁.有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤.
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物…
已知:焙烧中发生的主要反应为2FeCl3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化.
①氨水法除铁时,溶液pH应控制在3.2~6.5之间.
②补全ii中的操作:加水溶解,过滤,再加盐酸酸化至pH小于6.5.
③两种方法比较,氨水法除铁的缺点是引入杂质NH4+.
(3)过程Ⅲ的目的是除铅.加入的试剂是锰.
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g.则x=$\frac{{7({m_1}-{m_2})}}{m_2}$.
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性X>Y>Z | |
| C. | W、X、Y形成的化合物抑制水的电离 | |
| D. | m的分解产物中p为氧化产物,q为还原产物 |
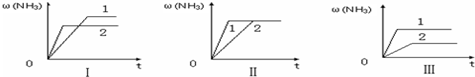
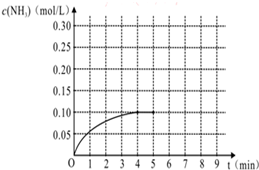 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图: