题目内容
9.短周期元素W,X,Y,Z的原子序数依次增加,由以上四种元素组成的一种化合物m在400℃完全分解,其反应式为3m$\frac{\underline{\;400℃\;}}{\;}$4n+p+3q+6r,n能使湿润的红色石蕊试纸变蓝,q能用品红试液检验,下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性X>Y>Z | |
| C. | W、X、Y形成的化合物抑制水的电离 | |
| D. | m的分解产物中p为氧化产物,q为还原产物 |
分析 n能使湿润的红色石蕊试纸变蓝,n为NH3,q能用品红试液检验,q为SO2,短周期元素W、X、Y、Z的原子序数依次增加,则W为H,X为N,Y为O,Z为S,m为(NH4)SO4,由元素及原子守恒可知发生3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O,以此来解答.
解答 解:由上述分析可知,W为H,X为N,Y为O,Z为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:W<Y<X<Z,故A错误;
B.非金属性越强,对应氢化物越稳定,则简单氢化物的稳定性Y>X>Z,故B错误;
C.W、X、Y形成的化合物为硝酸时抑制水的电离,若为硝酸铵时促进水的电离,故C错误;
D.3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O中N元素的化合价升高,S元素的化合价降低,则q为还原产物,p为氧化产物,故D正确;
故选D.
点评 本题考查无机物的推断,为高频考点,把握氨气、二氧化硫的性质及铵盐分解反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
17.将6.85g Fe和Al的混合物溶于200mL浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35g,若不考虑反应前后溶液体枳变化,则下列有关判断正确的是( )
| A. | Fe与A1的物质的量之比为1:1 | |
| B. | 混合气体中 NO为0.03mol,N2O0.12mol | |
| C. | 原HNO3溶液的浓度C=4.6mol/L | |
| D. | 反应中被还原的HNO3为0.18 mol |
4.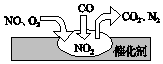 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
14.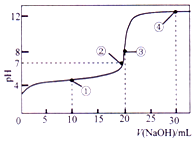 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH) |
1.设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl 分子 | |
| B. | 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA | |
| C. | 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| D. | 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA |
18.汽车尾气中所含污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )
| A. | 氮气 | B. | 硫化氢 | C. | 氨气 | D. | 氮的氧化物 |
19.下列关于石油加工的叙述中,不正确的是( )
| A. | 石油分馏所得的馏分是一种具有固定熔沸点的纯净物 | |
| B. | 石油裂化的主要目的是提高汽油等轻质油的产量 | |
| C. | 石油裂解的原料是石油分馏产物,包括石油气 | |
| D. | 石油的化学成分主要是各种液态的碳氢化合物,其中还溶有气态和固态的碳氢化合物 |
 .
.