题目内容
2.离子晶体一般不具有的特征是( )| A. | 熔点较高,硬度较大 | B. | 易溶于水而难溶于有机溶剂 | ||
| C. | 固体时不能导电 | D. | 离子间距离较大,其密度较小 |
分析 离子晶体由阴阳离子构成,离子键具有较强的作用力,一般来说离子晶体熔点较高,硬度较大,在熔融状态下可导线,易溶于水,以此解答.
解答 解:离子间通过离子键形成的晶体是离子晶体,所以构成离子晶体的物质熔沸点较高,硬度较大,易溶于水,而难溶于有机溶剂.由于离子晶体在固态时,不能电离出阴阳离子,所以离子晶体在固态时不难导电.
故选D.
点评 本题考查离子晶体知识,为高频考点,侧重于学生的双基的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
17.生活中处处有化学,下列相关表述正确的是( )
| A. | 苯酚对皮肤有腐蚀性 | B. | 乙醇是不可再生的能源 | ||
| C. | 质量分数100%的酒精为医用酒精 | D. | 天然橡胶的主要成分是异戊二烯 |
7.向含有5×10-3mol HIO3与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去.则在整个过程中( )
| A. | 共得到0.96g硫 | B. | 通入H2S的体积为336mL | ||
| C. | 硫元素先被还原后被氧化 | D. | 转移电子总数为3.0×10-2NA |
14.下列有关化学用语表示正确的是( )
| A. | S2-的结构示意图: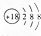 | |
| B. | 质子数为38,中子数为50的Sr原子:5038Sr | |
| C. | NH4Cl的电子式: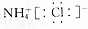 | |
| D. | PBr3的结构式: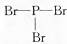 |
18.Fe与稀H2SO4反应制氢气,下列措施能使生成氢气的速率一定加快的是( )
| A. | 增加铁的量 | B. | 用浓硫酸代替稀硫酸 | ||
| C. | 加热 | D. | 增大压强 |
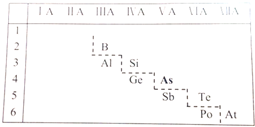
 ;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.
;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.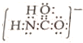 .
.

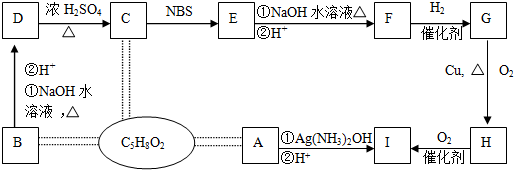
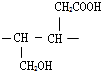 ;
;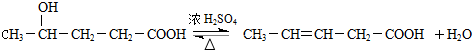 ;
;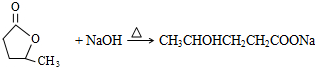 ;
;