题目内容
1.某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.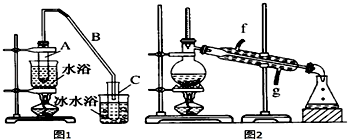
已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.
分析 (1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化.;
(2)①环己烯不溶于氯化钠溶液,且密度比水小,分层后环己烯在上层,由于分液后环己烯粗品中还含有少量的酸和环己醇,提纯产物时用c(Na2CO3溶液)洗涤可除去酸;
②为了使冷凝的效果更好,冷却水从冷凝管的下口进入,上口出;生石灰能与水反应生成氢氧化钙;
③根据表中数据可知,馏分环己烯的沸点为83℃;
a.若提前收集,产品中混有杂质,实际产量高于理论产量;
b.制取的环己烯物质的量增大,实验制得的环己烯精品质量高于理论产量;
c.粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量;
(3)根据混合物没有固定的沸点,而纯净物有固定的沸点,据此可判断产品的纯度.
解答 解:(1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,
故答案为:防止暴沸;冷凝;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化,
故答案为:进一步冷却,防止环己烯挥发;
(2)①环己烯是烃类,不溶于氯化钠溶液,且密度比水小,振荡、静置、分层后环己烯在上层,由于分液后环己烯粗品中还含有少量的酸和环己醇,联想:制备乙酸乙酯提纯产物时用c(Na2CO3溶液)洗涤可除去酸,
故答案为:上层;c;
②为了使冷凝的效果更好,冷却水从冷凝管的下口即g口进入;生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;
故答案为:g;除去了残留的水;
③根据表中数据可知,馏分环己烯的沸点为83℃,故收集产品应控制温度在83℃左右;
a.蒸馏时从70℃开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,故a错误;
b.环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,故b错误;
c.若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,故c正确,故选c;
故答案为:83℃;c;
(3)粗品中含有杂质环己醇,区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品;另外根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,也可判断产品的纯度,所以合理的为bd,
故答案为:bd.
点评 本题考查通过环己醇制备环己烯的实验方法,考查了制备方案的设计,题目难度中等,涉及物质的分离方法、冷凝、产量的分析等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
 | (1)镁原子在二维空间的配位数为6 (2)位于晶胞中部的镁原子与离它最近两平面相切(填“相离”或“相切”或”相交”) |
 | (3)铜原子在三维空间的配位数为12 (4)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$g/cm3(根号带在分子上) |
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 小苏打可与酸反应,可用作治疗胃酸过多的药剂 | |
| D. | 碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂 |
| A. | C、N、O、F | B. | Li、C、N、S | C. | Li、Na、Be、Mg | D. | F、Cl、Br、I |
| A. | 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性和咸的食物 | |
| C. | 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
 ;NH3:3H•+
;NH3:3H•+ →
→ ;Na2S:
;Na2S: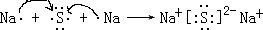 .
.