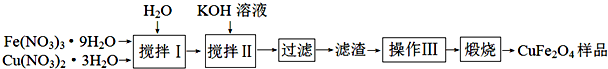
题目内容
11.化学与社会、生活密切相关.对下现象与事实的解释正确的是( )| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NO2与水反应生成硝酸和一氧化氮;
B.漂白粉中有效成分次氯酸钙和空气中二氧化碳水反应生成次氯酸和碳酸钙;
C.高锰酸钾溶液具有氧化性,乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,易被高锰酸钾溶液氧化;
D.草木灰中碳酸钾溶液中水解显碱性,氯化铵溶液中铵根离子水解显酸性.
解答 解:A.NO2与水反应生成硝酸和一氧化氮,不属于酸性氧化物,故A错误;
B.漂白粉中有效成分次氯酸钙和空气中二氧化碳水反应生成次氯酸和碳酸钙,次氯酸见光分解,漂白粉失效,故B错误;
C.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯含有不饱和键能被酸性高锰酸钾氧化,故C错误;
D.当施肥时草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,使N元素以氨气的形式逸出因而肥效会降低,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及盐类的水解、漂白粉、高锰酸钾溶液的性质、氧化还原反应的应用,题目难度不大,注意反应过程中实质的理解应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列离子方程式书写正确的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
19.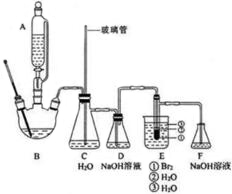 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
装置B中发生的反应为C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
合成反应:
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀地到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分装入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,使管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验室没有装置D
c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.装置B中发生的反应为C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀地到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分装入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,使管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验室没有装置D
c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
1.某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.
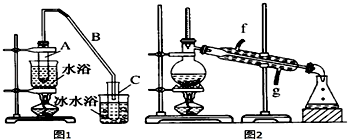
已知:
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.