题目内容
6.下列有关物质性质、应用的说法正确的是( )| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 小苏打可与酸反应,可用作治疗胃酸过多的药剂 | |
| D. | 碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂 |
分析 A.氨气易液化,液化时需要吸收大量的热;
B.碳酸氢钠受热分解生成二氧化碳;
C.小苏打为碳酸氢钠,与盐酸反应,消耗氢离子;
D.碳酸钠溶液显碱性是因为碳酸根离子水解,用作锅炉除垢时CaSO4沉淀的转化剂是因为碳酸钙的溶解度小于硫酸钙.
解答 解:A.氨气易液化,液化时需要吸收大量的热,液氨常用作制冷剂,故A错误;
B.NaHCO3用作糕点的膨松剂,是利用碳酸氢钠不稳定受热分解生成二氧化碳,故B错误;
C.小苏打为碳酸氢钠,与盐酸反应,消耗氢离子,可用作治疗胃酸过多的药剂,故C正确;
D.碳酸钠溶液显碱性是因为碳酸根离子水解,用作锅炉除垢时CaSO4沉淀的转化剂是因为碳酸钙的溶解度小于硫酸钙,二者无联系,故D错误;
故选:C.
点评 本题考查了物质的性质与用途之间的联系,熟悉物质的性质是解题关键,注意沉淀转化的规律,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
17.某同学写出下列烷烃的名称中,不正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
14.若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子“的变化.在变化的各阶段被破坏的粒子间主要的相互作用是( )
| A. | 氢键;分子间作用力;非极性键 | B. | 氢键;极性键;非极性键 | ||
| C. | 氢键;极性键;分子间作用力 | D. | 分子间作用力;氢键;非极性键 |
1.某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.
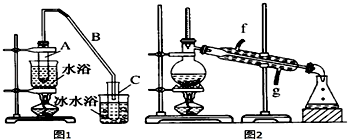
已知:
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.
11.电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物.其工业制取流程如图1:
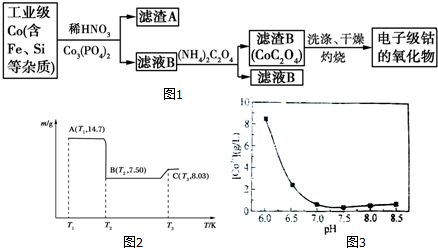
(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
b.CoSO4与NH4HCO3反应时,母液中钴离子含量与溶液pH关系图如图3:
由钴渣酸浸液制备氧化钴的实验步骤依次为(可选用的试剂:碳铵、稀硫酸、NaOH溶液)
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+沉淀完全;②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.

(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为(可选用的试剂:碳铵、稀硫酸、NaOH溶液)
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+沉淀完全;②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.
18.用H2O2处理含NaCN的废水的反应原理为:NaCN+H2O2+H2O═NaHCO3+NH3,已知:HCN酸性比H2CO3弱.下列有关说法正确的是( )
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 | |
| D. | 常温下,浓度均为0.1 mol•L-1 NaCN、NaHCO3溶液,前者的pH小于后者 |
15.A、B、C是周期表中相邻的三种主族元素,A和B同周期,B和C同主族,三种元素原子最外层电子数之和恰好为核内质子之和的$\frac{1}{2}$.则A、B、C三种元素分别是( )
| A. | N O P | B. | Li Be Mg | C. | C N P | D. | Ar Cl F |
16.某塑料的中间体M的结构简式为 ,有关说法错误的是( )
,有关说法错误的是( )
 ,有关说法错误的是( )
,有关说法错误的是( )| A. | M的分子式为C12H16O6 | |
| B. | 含有的官能团为羟基、酯基和碳碳双键 | |
| C. | 能发生酯化、水解、加成、氧化等反应 | |
| D. | 1molM能与3molH2加成 |