题目内容
氢气还原氧化铜:CuO+H2
H2O+Cu,在该反应中( )
| ||
| A、CuO做还原剂 |
| B、CuO做氧化剂 |
| C、铜元素的化合价降低 |
| D、铜元素的化合剂升高 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:在氧化还原反应中失电子化合价升高的物质作还原剂,得电子化合价降低的物质作氧化剂,注意氧化剂、还原剂必须是反应物.
解答:
解:A、该反应中氧化铜得电子化合价降低,所以CuO是氧化剂,故A错误;
B、该反应中氧化铜得电子化合价降低,所以氧化铜是氧化剂,故B正确;
C、反应前后,铜元素的化合价由+2价变为0价,所以铜元素的化合价降低,故C正确;
D、反应前后,铜元素的化合价由+2价变为0价,所以铜元素的化合价降低,故D错误.
故选BC.
B、该反应中氧化铜得电子化合价降低,所以氧化铜是氧化剂,故B正确;
C、反应前后,铜元素的化合价由+2价变为0价,所以铜元素的化合价降低,故C正确;
D、反应前后,铜元素的化合价由+2价变为0价,所以铜元素的化合价降低,故D错误.
故选BC.
点评:本题考查了氧化还原反应,根据化合价变化来判断氧化剂、还原剂即可,注意氧化剂和还原剂都必须是反应物不是产物,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质含有离子键的是( )
| A、N2 |
| B、CO2 |
| C、NaOH |
| D、HCl |
下列实验方案设计中,可行的是( )
| A、加氢氧化钠溶液,过滤,可直接除去混合物在铝粉中的铁粉 |
| B、用溶解、加热浓缩再冷却结晶的方法分离KNO3和NaCl固体混合物 |
| C、用分液的方法分离酒精和氯化钠溶液 |
| D、将Cl2和HCl的混合气体通过碱石灰可以除去其中的HCl |
下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A、常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)>c(H2A) |
| B、Na2CO3溶液:c(H+)-c(OH-)=c(HC03-)+2c(CO32-)-c(Na+) |
| C、向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO-)>c(OH-)>c(H+) |
| D、浓度均为0.1mol?L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2mol?L-1 |
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的化合价越高,其原子失电子能力越强 |
| B、第二周期元素从左到右,最高正价从+1递增到+7 |
| C、同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强 |
| D、IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
如表为元素周期表中短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )

| A、A与B形成的阴离子可能有:AB32-、A2B42- |
| B、E的氢化物的沸点比C的氢化物的沸点高 |
| C、D在过量的B中燃烧的主要产物为DB2 |
| D、A与E形成的化合物是非极性分子 |
 某晶体中含有A、B、C三种元素,其晶胞排列方式如图所示,晶体中A、B、C的原子个数之比依次为( )
某晶体中含有A、B、C三种元素,其晶胞排列方式如图所示,晶体中A、B、C的原子个数之比依次为( )| A、1:3:1 |
| B、2:3:1 |
| C、8:6:1 |
| D、4:3:1 |
 A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.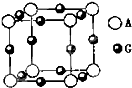 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.