题目内容
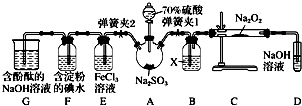
18.下列实验装置或操作设计合理的是( )| A. | B. | C. | D. |
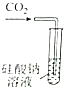 | 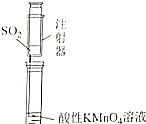 | 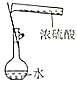 | 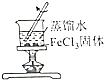 |
| 证明碳的非金属性比硅强 | 探究SO2的漂白性 | 配制一定物质的量浓度的稀硫酸 | 制取少量Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应;
B.二氧化硫与高锰酸钾发生氧化还原反应;
C.不能将浓硫酸直接注入容量瓶中;
D.在沸水中滴加饱和氯化铁溶液制备胶体.
解答 解:A.发生强酸制取弱酸的反应,可知碳酸酸性大于硅酸,则非金属性C>Si,故A正确;
B.二氧化硫与高锰酸钾发生氧化还原反应,可知二氧化硫具有还原性,不能验证漂白性,故B错误;
C.不能将浓硫酸直接注入容量瓶中,应在烧杯中稀释、冷却后转移,故C错误;
D.在沸水中滴加饱和氯化铁溶液制备胶体,不能利用固体,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力、实验能力的考查,把握相关反应原理、实验技能、实验装置的作用为解答的关键,题目难度不大.

练习册系列答案
相关题目
8.某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
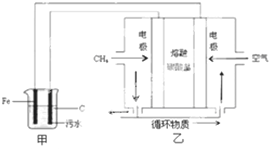

| A. | 通入空气的电极为阳极 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-=Fe3+ | |
| C. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
9. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池中电极b是正极 | |
| B. | 外电路中电子由电极b通过导线流向电极a | |
| C. | 该电池的正极反应为O2+4H++4e-=2H2O | |
| D. | 该电池的总反应:2H2+O2=2H2O |
6.市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹以及人体排放的蛋白质油渍等遇到它,皆能水解而除去.下列衣料中不能用加酶洗衣粉洗涤的是( )
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥尼龙织品.
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥尼龙织品.
| A. | ①②③ | B. | ②④ | C. | ③④⑤ | D. | ③⑤⑥ |
13.符合下列要求的同分异构体数目(不考虑立体异构)最少的是( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C5H12O的醇 | ||
| C. | 分子式为C5H10O2的羧酸 | D. | 分子式为C5H10O2的酯 |
3.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16,Y的原子半径比X的大,X与W同主族,Z是地壳中含量最高的金属元素,下列说法不正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素X、Y能形成多种化合物 | |
| C. | 元素W的简单气态氢化物的热稳定性比X的弱 | |
| D. | Y、W最高价氧化物所对应的水化物均能溶解Z的氢氧化物 |
10.在25℃时,向10mL0.01mol•L-1NaX溶液中逐滴加入0.01mol•L-1的盐酸溶液,滴定过程中溶液中HX、X-浓度所占分数(φ)随pH的变化曲线如图所示,据此判断下列说法中正确的是( )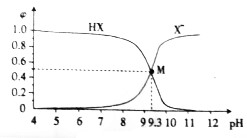

| A. | 25℃时,$\frac{c(HX)}{c({X}^{-})•c({H}^{+})}$=109.3 | |
| B. | M点溶液中存在:c(X-)+c(OH-)=c(H+)+c(Na+) | |
| C. | 滴加盐酸的过程中,水的电离程度先减小后增大 | |
| D. | 常温下,等浓度等体积的HX和NaX溶液混合后,溶液显酸性 |
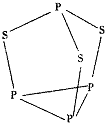 三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题: