��Ŀ����
8��ij��ˮ�к���Fe3+��Ag+��Cu2+�����ӣ�ij�������õ��ķ�����������ˮ������������ǣ�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3��Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã��ó���ˮ�������װ����ͼ��ʾ������˵����ȷ���ǣ�������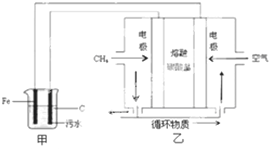
| A�� | ͨ������ĵ缫Ϊ���� | |
| B�� | ��װ����Fe�缫�ķ�ӦΪFe-3e-=Fe3+ | |
| C�� | Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ������ΪCO2 | |
| D�� | ����װ������1.6 g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ8.96 L |
���� ��װ��Ϊ���أ���װ��Ϊԭ���װ�ã�ԭ��ع���ʱ��ͨ������һ��Ϊ����������������Ӧ�������缫��Ӧ��CH4+4CO32--8e-=5CO2+2H2O��ͨ��������һ��Ϊ������������ԭ��Ӧ��������ӦΪO2+2CO2+4e-=2CO32-��������FeΪ����������Fe-2e-=Fe2+�������ĵ缫��ӦΪ��2H++2e-=H2�������������Ӿ��л�ԭ�ԣ��ܱ����������������ۣ�4Fe2++10H2O+O2=4Fe��OH��3��+8H+���Դ˽����⣮
��� �⣺A����װ��Ϊ���أ���װ��Ϊԭ���װ�ã�ԭ��ع���ʱ��ͨ������һ��Ϊ������ͨ�������һ��Ϊ��������A����
B��������Fe����������Fe-2e-=Fe2+����B����
C�������������̼����Ϊ����ʣ������缫��Ӧ��CH4+4CO32--8e-=5CO2+2H2O��������ӦΪO2+2CO2+4e-=2CO32-������ѭ�����õ�����ֻ�ж�����̼����C��ȷ��
D����صĸ����缫��Ӧ��CH4+4CO32--8e-=5CO2+2H2O������װ������1.6 gCH4�μӷ�Ӧ����0.1mol����μӷ�Ӧʱ����0.8mol����ת�ƣ�C�缫�ĵ缫��ӦΪ��2H++2e-=H2������C�缫���������������ڱ�״����Ϊ8.96L����D��ȷ��
��ѡ��CD��
���� ���⿼����ȼ�ϵ�صĹ���ԭ����ԭ��غ͵��ش������ۺ�֪ʶ���ѶȽϴ�ע����յ��غ�ԭ��صĹ���ԭ�������յ缫����ʽ����дΪ������Ĺؼ���

| A�� | �����������ʵ���Ҫԭ�� | |
| B�� | ����ʹ�ø�Ч���Ͷ����Ͳ����ĵ����������Ѻ���ũҩ | |
| C�� | �����ƹ��л��ȡ��л����л��ϳ�ũҩ | |
| D�� | �ʺͼطʿɴ������л�� |
| A�� | Ǧ��о����Ҫ�ɷ��ǽ���Ǧ | |
| B�� | CO�����ж���������¯��ľ����ж�ż���ˮ��������CO | |
| C�� | ����ϴ�·۵Ĵ���ʹ�û����ˮ�帻Ӫ���� | |
| D�� | ˮ�ࡢ���������϶��Ǹ߷��Ӳ��� |
 120�������£�һ��������ij�л��ֻ��C��H��O����Ԫ���е����ֻ����֣�������O2��ȼ�պ�����������ͨ��ŨH2SO4��ŨH2SO4����2.7g����ͨ����ʯ�ң���ʯ������4.4g���Ը��л�����к˴Ź����������ͼ��ͼ��ʾ������л�������ǣ�������
120�������£�һ��������ij�л��ֻ��C��H��O����Ԫ���е����ֻ����֣�������O2��ȼ�պ�����������ͨ��ŨH2SO4��ŨH2SO4����2.7g����ͨ����ʯ�ң���ʯ������4.4g���Ը��л�����к˴Ź����������ͼ��ͼ��ʾ������л�������ǣ�������| A�� | CH3CH3 | B�� | CH3CH2COOH | C�� | CH3CH2OH | D�� | CH3CH��OH��CH3 |
CH3CH2CH2CH3��g��+$\frac{13}{2}$O2��g����4CO2��g��+5H2O��l����H=-2878kJ•mol-1
��CH3��2CHCH3��g��+$\frac{13}{2}$O2��g����4CO2��g��+5H2O��l����H=-2869kJ•mol-1
������˵����ȷ���ǣ�������
| A�� | �������ȼ���ȴ����춡�飬������������е�̼������춡��Ķ� | |
| B�� | ��������ȶ��Դ����춡�� | |
| C�� | ������ת��Ϊ�춡��Ĺ�����һ�����ȹ��� | |
| D�� | ��������Ӵ��������С���춡����� |
| A�� | ��AlCl3��Һ������Ӧ�����ӷ���ʽΪAl3++3OH-�TAl��OH��3�� | |
| B�� | ����Һ��pH=13 | |
| C�� | ��HNO3��Һ��ȫ�кͺ���Һ������ | |
| D�� | ��������NH4Cl�����$\frac{c��O{H}^{-}��}{c��N{H}_{3}•{H}_{2}O��}$��ֵ��С |
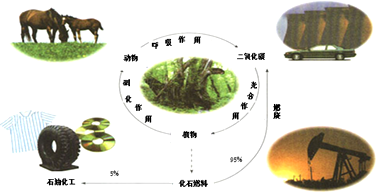
��1���й�̼ѭ����˵������ȷ����ac
a����������ǹ���ת���ɻ�ѧ��b����ʯȼ���ǿ�������
c��ѭ��������������ԭ��Ӧd��ʯ���к���ϩ����ϩ��ͨ���Ӿ۷�Ӧ�õ��߷��ӻ�����
��2�����ɵ��������������һ�������¿�ֱ�ӹ���ֽ�CO2������Ӧ��2CO2��g��=2CO��g��+O2��g�����÷�Ӧ�ġ�H0������ѡ���������=����
��3��CO2ת��;��֮һ�ǣ�����̫���ܻ��������ֽܷ�ˮ��H2��Ȼ��H2��CO2ת��Ϊ�״������������ʣ�
2H2O��1��=2H2��g��+O2��g����H=+571.5kJ•mol-1
3H2��g��+CO2��g��=CH3OH��l��+H2O��1����H=-137.8kJ•mol-1
��Ӧ��4H2O ��1��+2CO2��g��=2CH3OH��l��+3O2��g����H=kJ•mol-1��
����Ϊ�÷�����Ҫ����ļ��������У���
a�������������
b���������ȡ�������ӷ�Ӧ��ϵ����Ч���룬����CO2��ת����
c��������̼��ˮ��Դ����Դ��Ӧ
��4����ϡ��ˮ��������CO2���տɵò�ƷNH4HCO3���ڲ���ʱ�����������м���NH2COONH4����������泥����ɣ��ֽ�һ���������İ�����������ں��ݵ��ܱ���������У��ֱ��ڲ�ͬ�¶��½��з�Ӧ��NH2COONH4��s��?2NH3��g��+CO2��g����ʵ���õ��й����ݼ��±����� t1��t2��t3��
| �¶ȣ��棩 ������Ũ�� ��mol/L�� ʱ�䣨min�� | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9��10-3 | 2.7��10-2 | 8.1��10-2 |
| t2 | 3��10-2 | 4.8��10-2 | 9.4��10-2 |
| t3 | 3��10-2 | 4.8��10-2 | 9.4��10-2 |
��5����һ�ּ���ˮ��Һ������ʣ�CO2�����ԭΪ̼�⻯�����ԭ����ͼ�����������ϲ�����ϩ�ĵ缫��Ӧ����ʽΪ��2CO2+12H++12e-=CH2=CH2+4H2O��

| A�� | B�� | C�� | D�� |
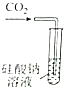 | 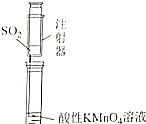 | 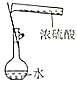 | 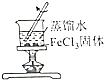 |
| ֤��̼�ķǽ����Աȹ�ǿ | ̽��SO2��Ư���� | ����һ�����ʵ���Ũ�ȵ�ϡ���� | ��ȡ����Fe��OH��3���� |
| A�� | A | B�� | B | C�� | C | D�� | D |