题目内容
5. 氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:
氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:(1)氨气可由N2和H2反应制取,N2(g)+3H2(g)?2NH3(g)反应过程的能量变化如图所示:已知1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1molN-H键时释放390.8kJ的能量.
①图中E的大小对该反应热有无影响?无影响.该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?降低,理由催化剂参与反应,改变了反应路径,降低反应的活化能.
②图中△H=-94.8kJ/mol.
③如果反应速率v(H2)为0.15mol/(L•min),则v(N2)=0.05 mol/(L•min),v(NH3)=0.1mol/(L•min).
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(l)?△H=-19.5kJ•mol-1
N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.2kJ•mol-1
请写出肼和 N2O4反应的热化学反应方程式2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g)△H=-1049.9kJ/mol.
分析 (1)①加入催化剂,可以使得活化能减小,反应速度加快;
②根据反应N2(g)+3H2(g)?2NH3(g)结合1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1molN-H键时释放390.8kJ的能量计算反应热;
③依据化学反应速率之比等于系数之比计算得到.
(2)已知①N2(g)+2O2(g)═N2O4(l),△H=-19.5kJ/mol;
②N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534.7kJ/mol;
利用盖斯定律将②×2-①可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热.
解答 解:(1)①因图中A、C分别表示反应物总能量、生成物总能量,而E为反应的活化能,由于反应热的大小取决于反应物和生成物的总能量的相对大小,故E的大小对反应热无影响;加入催化剂,改变了反应路径,使反应的活化能减小,即B点降低.
故答案为:无影响;降低;催化剂参与反应,改变了反应路径,降低反应的活化能;
②根据反应N2(g)+3H2(g)?2NH3(g)结合1molN2分子中的化学键断裂时需要吸收942kJ的能量、1molH2分子中的化学键断裂时需要吸收436kJ的能量、形成1molN-H键时释放390.8kJ的能量,可知,反应的反应热△H=942kJ/mol+3×436kJ/mol-390.8kJ/mol×6=-94.8KJ/mol,
故答案为:-94.8KJ/mol;
③由于v(H2)=0.15mol/(L•min),而化学反应速率之比等于系数之比,故v(N2)=$\frac{1}{3}$v(H2)=0.05mol/(L•min),v(NH3)=2v(N2)=0.1mol/(L•min),
故答案为:0.05;0.1mol/(L•min);
(2)已知①N2(g)+2O2(g)═N2O4(l),△H=-19.5kJ/mol;
②N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534.7kJ/mol;
利用盖斯定律将②×2-①可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g),
△H=(-534.7kJ/mol)×2-(-19.5kJ/mol)=-1049.9kJ/mol,
故答案为:2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g)△H=-1049.9kJ/mol.
点评 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用,易错点为催化剂的使用只影响活化能,但不影响反应热.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 64g | B. | 64 | C. | 64g/mol | D. | 32g/mol |
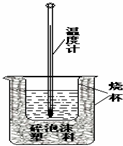 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示. (1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和环形玻璃搅拌棒
(2)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 |
(4)如果用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,中和热实验数值偏低.(填“偏高”,“无影响”或“偏低”)
| A. | 钾的相对原子质量较大 | |
| B. | 钾的密度比钠小 | |
| C. | 钾的原子半径大,失去电子的能力强 | |
| D. | 钾比钠与水反应更剧烈 |
| A. | KCl、Na2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、K2SO4、Na2SO4 |
| A. | 稀硫酸 | B. | 浓盐酸 | C. | 浓硫酸 | D. | 浓氢氧化钠溶液 |
| A. | 常温下,浓硫酸可以用铁制槽罐存放,说明铁与浓硫酸不反应 | |
| B. | 检验氯化氢中是否混有氯气,可采用湿润的有色布条 | |
| C. | 镁在空气中燃烧只生成氧化镁 | |
| D. | 钠可以从硫酸铜溶液中置换出金属铜 |
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: