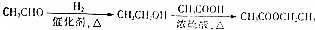题目内容
12. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)Z2Y2的电子式为
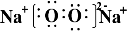 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、(2)Z2Y2遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为
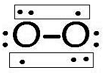 ,其分子空间构型为直线型.
,其分子空间构型为直线型.(3)X、Y、Z、W四种元素所形成的单质中,硬度最大的是金刚石(填物质的名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体而CCl4为分子晶体;XW4中X原子的杂化轨道类型为sp3.
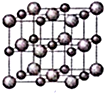
(4)ZW晶体的结构示意图如图所示.设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3.阿伏伽德罗常数为NA,则晶体中两个最近的Z离子中心间的距离=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$.
分析 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,
①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的,则为N;
②Y元素是地壳中含量最多的元素,则Y为O;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子,则W为Cl,
③Z元素的电离能数据可知,Z最外层有1个电子,原子序数比O的大,则为Na,然后结合元素及化合物知识及化学用语来解答.
解答 解:X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,
①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的,则为N;
②Y元素是地壳中含量最多的元素,则Y为O;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子,则W为Cl,
③Z元素的电离能数据可知,Z最外层有1个电子,原子序数比O的大,则为Na,
(1)Z2Y2的电子式为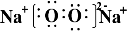 ,过氧根离子中氧原子和原子间以非极性键结合,钠离子与过氧根离子间以离子键结合,过氧化钠属于离子化合物,
,过氧根离子中氧原子和原子间以非极性键结合,钠离子与过氧根离子间以离子键结合,过氧化钠属于离子化合物,
故答案为: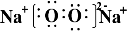 ;离子键、非极性键;离子;
;离子键、非极性键;离子;
(2)Z2Y2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,基态O2分子中并不存在双键,氧分子里形成了两个三电子键.两个氧原子进行sp轨道杂化,一个单电子填充进sp杂化轨道,成σ键,另一个单电子填充进p轨道,成π键.所以氧气结构式为 ,分子构型为直线型,
,分子构型为直线型,
故答案为: ; 直线型;
; 直线型;
(3)X、Y、Z、W四种元素所形成的单质中,只有C形成的金刚石为原子晶体,其硬度最大、熔点最高.NaCl为离子晶体而CCl4为分子晶体,一般情况下离子晶体的熔点大于分子晶体的.CCl4中C原子电子对数为$\frac{4+1×4}{2}$=4,孤电子对数为0,故杂化方式为sp3,
故答案为:金刚石;NaCl为离子晶体而CCl4为分子晶体;sp3;
(4)根据NaCl晶体的结构示意图可知,每个晶胞中含有钠离子数为$8×\frac{1}{8}+6×\frac{1}{2}=4$=4,氯离子数为12×$\frac{1}{4}$+1=4,根据ρ=$\frac{m}{V}$可知,V=$\frac{\frac{4M}{{N}_{A}}}{ρ}$=$\frac{4M}{ρ{N}_{A}}$,所以晶胞的边长为$\root{3}{\frac{4M}{ρ{N}_{A}}}$,晶胞的面对角线为$\sqrt{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$,根据晶胞结构可知,NaCl晶体中两个最近的钠离子中心间的距离d应为晶胞面对角线的一半,所以d=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$,
故答案为:$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$.
点评 本题考查物质结构及其性质,推断元素是解答本题关键,注意利用价层电子对互斥理论分析分子空间构型,综合性较强,题目难度不大.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
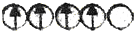 ,而不排布成
,而不排布成 ,其直接的根据是( )
,其直接的根据是( )| A. | 能量最低原理 | B. | 洪特规则 | C. | 原子轨道能级图 | D. | 泡利不相容原理 |
| A. | 0.2 mol/L 和0.1 mol/L的氨水中c(OH-)之比 | |
| B. | H2S溶液中c(H+)与c(S2-)之比 | |
| C. | Na2S溶液中c(Na+)与c(S2-)之比 | |
| D. | Na2O2晶体中阳离子与阴离子个数之比 |
| A. | 常温下1LpH=11的氨水中含有阳离子总数为0.001NA | |
| B. | 4g${\;}_{1}^{2}$H2中所含的质子数为4NA | |
| C. | 1mol甲醇中含有C-H键的数目为4NA | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个氧原子 |
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制成溴苯 | |
| C. | 蔗糖溶液加稀H2SO4加热后再加新制银氨溶液制银镜 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| A. | 分馏石油气和裂解气可用溴水进行鉴别 | |
| B. | 异丁烷的二氯取代物有3种(不考虑立体异构) | |
| C. | 主链含四个碳的烷烃中,碳原子个数是最多的是2,3-四甲基丁烷 | |
| D. | 乙醇和甘油都含羟基,葡萄糖和蔗糖都是糖类,但它们之间不是同系物 |
| A. |  将海带灼烧成灰 将海带灼烧成灰 | B. |  过滤得含I-的溶液 过滤得含I-的溶液 | ||
| C. |  向滤液中加稀H2SO4和H2O2溶液 向滤液中加稀H2SO4和H2O2溶液 | D. |  加入CCl4,萃取 加入CCl4,萃取 |
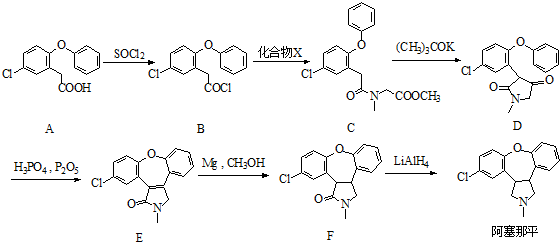
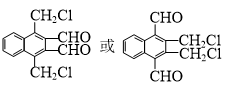 .
.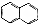 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;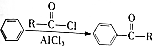 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和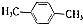 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: