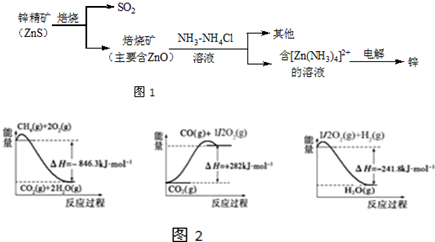
题目内容
15.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放人2mol•L-1H2SO4溶液中,乙同学将电极放入2mol•L-1的NaOH溶液中,如图所示.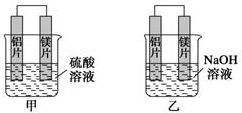
(1)甲池中,镁片上发生氧化(填“氧化”或“还原”)反应,硫酸根离子往负极(填“正极”或“负极”)迁移;写出甲池中正极的电极反应式:2H++2e-=H2↑.
(2)写出乙池中负极的电极反应式:Al+4OH--3e-=AlO2-十2H2O.
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出活动性更强,而乙会判断出Al活动性更强(填写元素符号).
(4)由此实验,以下结论正确的是AD.
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析.
分析 甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O═2NaAlO2+3H2↑.由于Al显两性,与酸碱都能发生反应,(1)甲中镁易失电子作负极,Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)乙池中铝易失电子作负极,铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验证明说明电解质溶液性质选用选择合适的介质,不能说明金属活动性顺序过时;
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
解答 解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,在原电池中,阴离子移向负极,即硫酸根离子移向负极.
故答案为:氧化;负极;2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,
故答案为:Mg;Al;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故A正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故B错误;
C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故C错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故D正确;
故答案为:AD.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,为易错点.

| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
| A. | NaOH(固体) | B. | KNO3 | C. | HCl | D. | CH3COONa(固体) |
| A. | 铅蓄电池属于二次电池 | |
| B. | 锂离子电池是一种一次性电池 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 镍镉电池中,Cd为负极,NiO(OH)为正极 |
| 编号 | A的分子式 | B的分子式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
| A. | 需要加热才能发生的反应,一定是吸收能量的反应 | |
| B. | 在化学反应过程中总是伴随着能量的变化 | |
| C. | 释放能量的反应在常温下一定很容易发生 | |
| D. | 在确定的化学反应中反应物的总能量总是高于生成物的总能量 |
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |