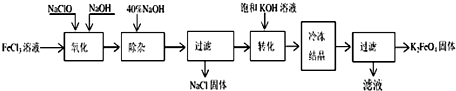
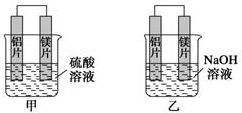
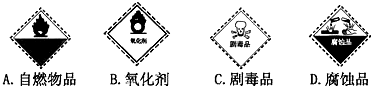
题目内容
7.饱和烃A和不饱和烃B在常温下均为气体(碳原子数不大于4),其中A分子中含有碳原子数多于B.将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合.将结果填入下表.| 编号 | A的分子式 | B的分子式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
分析 根据体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下3.6LCO2,可知混合气体的平均分子式为C3.6Hx,然后根据要想碳原子的平均值为3.6,必须有一种烃的碳原子数小于3.6,另一种烃的碳原子数大于3.6,且碳原子数若>4,那么常温下不是气体,故一种烃中最多为4个碳,据此讨论即可;
解答 解:因1升混合气体充分燃烧后生成3.6升CO2,且A分子的碳原子数比B分子的多,混合气体只能由碳原子数大于3.6的烷烃(C4H10)和碳原子数小于3.6的烯烃或炔烃(C3H6和C2H4、C3H4和C2H2)组成.它们有四种可能的组合:C4H10、C3H6;C4H10、C2H4;C4H10、C3H4;C4H10、C2H2,故答案为:
| 编号 | A的分子式 | B的分子式 |
| ① | C4H10 | C2H4 |
| ② | C4H10 | C2H2 |
| ③ | C4H10 | C3H6 |
| ④ | C4H10 | C3H4 |
点评 本题考查有机物的燃烧和差量法的使用,有一定的难度,注意根据燃烧的方程式进行判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.地壳中硅元素的主要存在形式是( )
| A. | 二氧化硅 硅酸盐 | B. | 四氯化硅 硅酸 | ||
| C. | 碳化硅 硅酸钠 | D. | 硅 硅酸盐 |
18.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 氮氧化物和氟氯烃的排放引发臭氧空洞 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 沸点:正丁烷>异丁烷 |
12.下列各组物质中化学键的类型相同的是( )
| A. | Na2O和Na2O2 | B. | N2和Ne | C. | MgCl2和Na2S | D. | HCl和NaOH |
16.下列关于化学键的叙述正确的是( )
| A. | 阴、阳离子通过静电吸引形成的强烈的相互作用 | |
| B. | 只由非金属元素组成的化合物不可能是离子化合物 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 只有活泼金属与活泼非金属之间才能形成离子键 |
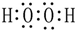 .
.
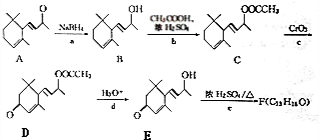
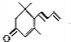 .(已知一个碳原子上不能连接两个碳碳双键)
.(已知一个碳原子上不能连接两个碳碳双键)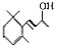 +CH3COOH$→_{△}^{浓硫酸}$、
+CH3COOH$→_{△}^{浓硫酸}$、 +H2O.
+H2O.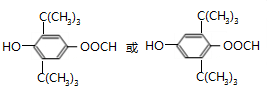
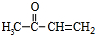 为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线.
为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线. $→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$
$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$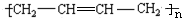 .
.