题目内容
20.将等物质的量的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)?2HI(g)(正反应放热),反应经过5分钟测得碘化氢的浓度
为0.5mol/L,碘蒸气的浓度为0.25mol/L.请填写以下的空白:
(1)求反应速率v(HI)=0.1 mol/(L•min);v(H2)=0.05 mol/(L•min);氢气的起始浓度=0.5mol/L.
(2)若上述反应达到平衡时,则平衡浓度C(HI)、C(I2)、C(H2)的关系是均为恒量(填“相等”、“2:1:1”或“均为恒量”)
(3)反应过程中混和气体的总物质的量不变(填“增大”、“减小”或“不变”)
分析 (1)根据v=$\frac{△c}{△t}$计算v(HI);
根据速率之比等于化学计量数之比,结合v(HI),计算v(H2);
根据碘化氢的浓度计算I2的浓度变化量,5min时I2的浓度加I2的浓度变化量等于I2的起始浓度.开始等氢气和碘蒸气的物质的量相等,所以起始浓度相等;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化;
(3)由方程式可知反应前后气体的化学计量数相等,混合气体的总物质的量不变.
解答 解:(1)v(HI)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min );
根据速率之比等于化学计量数之比,所以v(H2)=$\frac{1}{2}$v(HI)=$\frac{1}{2}$×0.1mol/(L•min )=0.05mol/(L•min );
I2的浓度变化量△c(I2)=$\frac{1}{2}$△c(HI)=$\frac{1}{2}$×0.5mol/L=0.25mol/L.
所以I2的起始浓度c(I2)=0.25mol/L+0.25mol/L=0.5mol/L.
开始等氢气和碘蒸气的物质的量相等,所以二者起始浓度相等.
所以氢气的起始浓度为0.5mol/L.
故答案为:0.1mol/Lmin;0.05mol/Lmin;0.5mol/L;
(2)化学反应达到化学平衡状态时,各物质的浓度不再发生变化,所以平衡浓度C(HI)、C(I2)、C(H2)均为恒量,
故答案为:均为恒量;
(3)由方程式可知反应前后气体的化学计量数相等,所以混合气体的总物质的量不变,
故答案为:不变.
点评 本题考查反应速率的有关计算、化学平衡状态的判断等,题目难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
11.符号为M的能层所含的能级有几种( )
| A. | 2 | B. | 3 | C. | 8 | D. | 18 |
12.下列各组物质中化学键的类型相同的是( )
| A. | Na2O和Na2O2 | B. | N2和Ne | C. | MgCl2和Na2S | D. | HCl和NaOH |
9.下列物质间的转化不能通过一步反应完成的是( )
| A. | SiO2→Si | B. | SiO2→H2SiO3 | C. | Si→Na2SiO3 | D. | CO2→C |
 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式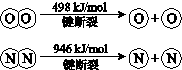
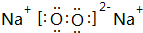 ,其中含有的化学键为离子键和共价键.
,其中含有的化学键为离子键和共价键.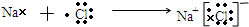 .
. 

 .
.
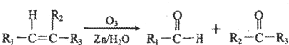
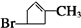
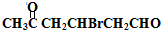 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$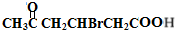 +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.