题目内容
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.
已知:①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) .
(3)W的基态原子的外围电子排布式为 .
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,1molM分子中σ键和π键的个数比为 .
(5)基态Z原子的电子排布图为 ;
(6)上述七种元素中最高价氧化物对应水化物酸性最强的是 ,(填写化学式)碱性最强的是 ;(填写电子式)
(7)X、T形成的X6T6中的键角约是 .
已知:①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)元素Y的原子核外共有
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)
(3)W的基态原子的外围电子排布式为
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,1molM分子中σ键和π键的个数比为
(5)基态Z原子的电子排布图为
(6)上述七种元素中最高价氧化物对应水化物酸性最强的是
(7)X、T形成的X6T6中的键角约是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:①W的原子序数为29,则W是Cu元素;
②T原子所处的周期数、族序数分别与其原子序数相等,则T是H元素;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则X是C元素;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小,且Q原子序数大于X,所以Q是Na元素;
④Z的基态原子价电子排布为ns2npn+2,且Z原子序数小于Q,Z属于第二周期元素,所以n=2,则Z是O元素,Y是N元素;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子,且原子序数大于Q,则R是Cl元素,据此解答各小题即可.
②T原子所处的周期数、族序数分别与其原子序数相等,则T是H元素;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则X是C元素;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小,且Q原子序数大于X,所以Q是Na元素;
④Z的基态原子价电子排布为ns2npn+2,且Z原子序数小于Q,Z属于第二周期元素,所以n=2,则Z是O元素,Y是N元素;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子,且原子序数大于Q,则R是Cl元素,据此解答各小题即可.
解答:
解:依据分析可知:W为铜,T为氢,X为碳,Y为氮,Z为氧,Q为钠,R为氯,
(1)元素Y为N,N原子核外共有7种不同运动状态的电子,有1s、2s、2p3种不同能级,故答案为:7;3;
(2)元素的非金属性越强,其电负性越大,由于非金属性O>N>C,故电负性:O>N>C,故答案为:O>N>C;
(3)Cu处于第四周期第ⅠB族,故外围电子排布式为:3d104s1,故答案为:3d104s1;
(4)H、C、O三种元素组成的一种化合物M是新装修居室中常见的有害气体,该气体为甲醛,它的分子式为CH2O,结构简式为HCHO,分子空间构型为平面三角形,1mol甲醛分子中含有σ键3mol,π键1mol,故σ键和π键个数比为3:1,故答案为:3:1;
(5)Z为O,O的核外电子排布式为: ,故答案为:
,故答案为: ;
;
(6)元素的非金属性越强,其最高价氧化物的水化物酸性越强,由于在这些元素中,除O(无含氧酸)外Cl的非金属性最强,故高氯酸的酸性最强;元素的金属性越强,其最高价氧化物的水化物的碱性越强,在这些元素中Na的金属性最强,故氢氧化钠碱性最强,氢氧化钠的电子式为: ,
,
故答案为:HClO4; ;
;
(7)C、H形成的化合物苯(C6H6),苯成平面正六边形,故键角为120°,故答案为:120°.
(1)元素Y为N,N原子核外共有7种不同运动状态的电子,有1s、2s、2p3种不同能级,故答案为:7;3;
(2)元素的非金属性越强,其电负性越大,由于非金属性O>N>C,故电负性:O>N>C,故答案为:O>N>C;
(3)Cu处于第四周期第ⅠB族,故外围电子排布式为:3d104s1,故答案为:3d104s1;
(4)H、C、O三种元素组成的一种化合物M是新装修居室中常见的有害气体,该气体为甲醛,它的分子式为CH2O,结构简式为HCHO,分子空间构型为平面三角形,1mol甲醛分子中含有σ键3mol,π键1mol,故σ键和π键个数比为3:1,故答案为:3:1;
(5)Z为O,O的核外电子排布式为:
 ,故答案为:
,故答案为: ;
;(6)元素的非金属性越强,其最高价氧化物的水化物酸性越强,由于在这些元素中,除O(无含氧酸)外Cl的非金属性最强,故高氯酸的酸性最强;元素的金属性越强,其最高价氧化物的水化物的碱性越强,在这些元素中Na的金属性最强,故氢氧化钠碱性最强,氢氧化钠的电子式为:
 ,
,故答案为:HClO4;
 ;
;(7)C、H形成的化合物苯(C6H6),苯成平面正六边形,故键角为120°,故答案为:120°.
点评:本题考查了物质结构和性质,正确推断元素是解本题关键,明确电负性大小、核外电子排布式、键角等即可解答,难度中等.

练习册系列答案
相关题目
 某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )
某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )| A、Ksp〔Fe (OH)3〕<Ksp〔Cu (OH)2〕 |
| B、加适量NH4Cl固体可使溶液由a 点变到b点 |
| C、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| D、Fe (OH)3、Cu (OH)2分别在b、c两点代表的溶液中达到饱和 |
氯菊酯属低毒杀虫剂结构如图所示,下列有关氯菊酯说法正确的是( )
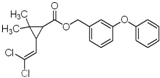

| A、分子式为C21H20Cl2O3 |
| B、不能使溴水褪色 |
| C、1mol氯菊酯与氢气加成最多消耗8 mol H2 |
| D、与NaOH溶液反应最多消耗4mol NaOH |
 某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)
某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)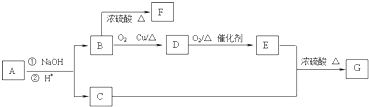
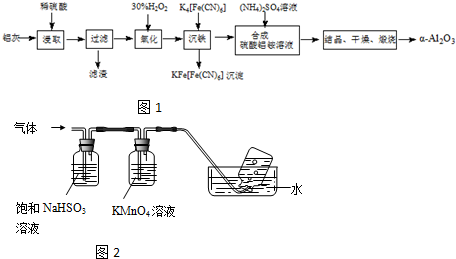
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下: