题目内容
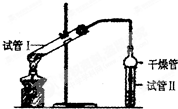 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH| 浓H2SO4 |
| △ |
为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 | |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
(2)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是
(3)分析实验
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)试管Ⅱ中的试剂用于吸收乙酸乙酯,通常使用饱和碳酸钠溶液;球形干燥管容积较大,利于乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用;
(2)对比试验关键是要采用控制变量,即控制一个变量,其它条件不变,所以可以从控制变量的角度来分析解答;
(3)根据实验A和实验B的数据进行解答;水在酯化反应中为生成物,从生成物对化学平衡的影响角度分析
(4)乙酸和乙醇容易挥发,且温度过高容易发生副反应.
(2)对比试验关键是要采用控制变量,即控制一个变量,其它条件不变,所以可以从控制变量的角度来分析解答;
(3)根据实验A和实验B的数据进行解答;水在酯化反应中为生成物,从生成物对化学平衡的影响角度分析
(4)乙酸和乙醇容易挥发,且温度过高容易发生副反应.
解答:
解:(1)球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用,故答案为:冷凝,防倒吸;
(2)本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3mol?L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3mol?L-1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol?L-1,
故答案为:6,6;
(3)对照实验A和B可知:试管Ⅰ中试剂实验A比实验B多1mL18mol?L-1 浓硫酸,但是试管Ⅱ中试剂中测得有机层乙酸乙酯的厚度,实验A为5.0cm,而实验B只有0.1cm,说明浓硫酸的吸水性提高了乙酸乙酯的产率;酯化反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动,
故答案为:A;浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,实验发现温度过高,乙酸乙酯的产率反而降低,是由于乙酸、乙醇都易挥发,使产率降低,或因温度过高可能发生副反应使产率降低,如乙醇在140℃,在浓硫酸催化下脱水生成乙醚,
故答案为:乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
(2)本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3mol?L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3mol?L-1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol?L-1,
故答案为:6,6;
(3)对照实验A和B可知:试管Ⅰ中试剂实验A比实验B多1mL18mol?L-1 浓硫酸,但是试管Ⅱ中试剂中测得有机层乙酸乙酯的厚度,实验A为5.0cm,而实验B只有0.1cm,说明浓硫酸的吸水性提高了乙酸乙酯的产率;酯化反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动,
故答案为:A;浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,实验发现温度过高,乙酸乙酯的产率反而降低,是由于乙酸、乙醇都易挥发,使产率降低,或因温度过高可能发生副反应使产率降低,如乙醇在140℃,在浓硫酸催化下脱水生成乙醚,
故答案为:乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
点评:本题考查了乙酸乙酯的制备方法、温度对反应速率、化学平衡的影响等知识,题目难度中等,注意把握乙酸乙酯的制备原理和实验方法,明确影响反应速率、化学平衡的因素.

练习册系列答案
相关题目
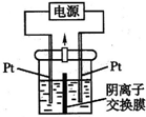 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )| A、右侧发生的电极方程式:2H2O+2e-=H2↑+2OH- | ||||
| B、电解结束时,右侧溶液中含有IO3- | ||||
C、电解槽内发生反应的总化学方程式KI+3H2O
| ||||
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )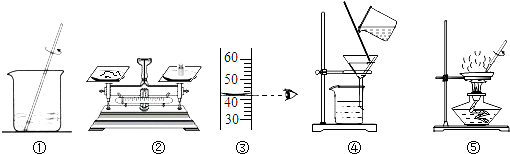

| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |


 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题: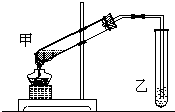 如图是某学生设计的制取乙酸乙酯的实验装置图,并采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,并采取了以下主要实验操作: 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途. 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.