题目内容
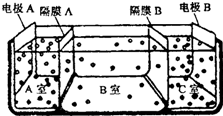
15.将3mol的NO2气体依次通入下列三个分别装有足量①NaHCO3饱和溶液 ②浓H2SO4 ③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是(同温、同压下测定)( )| A. | 1 mol NO | B. | 1 mol NO2和0.05 mol O2 | ||
| C. | 2 mol O2 | D. | 0.25 mol O2 |
分析 3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体与过氧化钠发生反应2CO2+2Na2O2═2Na2CO3+O2、2NO+O2=2NO2,从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,以此来解答.
解答 解:3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2,生成1molO2,再发生反应2NO+O2=2NO2,1molNO消耗0.5molO2,生成1molNO2,故从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,1molNO2消耗O2为1mol×$\frac{1}{4}$=0.25mol,故最终剩余的氧气为0.5mol-0.25mol=0.25mol,故最终收集到的气体是0.25molO2,
故选D.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

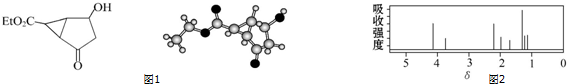
该有机分子的核磁共振氢谱图如图2(单位是ppm):
下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
| A. | K>K+ | B. | Na+>Mg2+>Al3+ | C. | Na+>F- | D. | Cl->Na+ |
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2与O3互为同位素 | |
| C. | CH3-CH2-OH与CH3-O-CH3互为分异构体 | |
| D. | H2O与D2O互为同分异构体 |
| A. | 2-甲基-2-丁烯 | B. | 2-丁炔 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二炔 |
| A. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
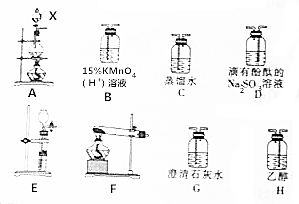 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.