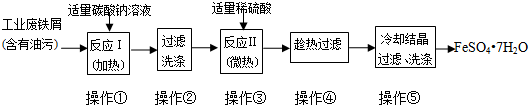
题目内容
6.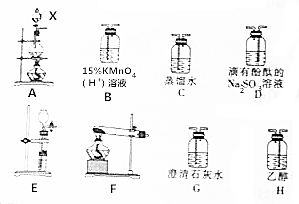 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.(1)仪器X的名称为分液漏斗.
(2)制备CH3Cl的化学方程式为CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O.
(3)制备CH3Cl的反应过程中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近),其目的是增大盐酸的量以提高甲醇的转化率.
(4)据文献记录,CH3Cl可被酸性高锰酸钾溶液氧化,氧化过程中可产生黄绿色气体.
①为验证其氧化产物,选择装置的先后顺序是ACBDG.
②连接好装置后,首先进行的操作是检查装置的气密性.
③装置D的实验现象是溶液红色逐渐褪去.
分析 本题是利用甲醇与浓盐酸反应制备CH3Cl,涉及具体的制备过程是先在干燥的HCl气流中加热ZnCl2晶体得到无水ZnCl2,再将无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶并滴加一定量的甲醇,经加热后会有CH3Cl生成,因CH3Cl中混有挥发出的HCl及甲醇,选择排水法收集生成的气体的同时还可以除杂,另外还探究了的稳定性及含有CH3Cl尾气的处理;
(1)X仪器为分液漏斗;
(2)根据题干信息可得,制备CH3Cl的化学方程式为CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O;
(3)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率;
(4)用A装置制备CH3Cl,C装置除去挥发出来的HCl,B装置制备氯气,D装置检验氯气的产生,G装置吸收多余的氯气,防止空气污染,
①为验证其氧化产物氯气,选择装置的先后顺序是ACBDG;
②连接好装置后,首先进行的操作是检查装置的气密性;
③Na2SO3溶液呈碱性,滴有酚酞的溶液为红色,同时Na2SO3具有较强还原性,与强氧化性物质Cl2会被氧化成Na2SO4溶液,装置D的实验现象是溶液红色逐渐褪去.
解答 解:(1)看图知X仪器为分液漏斗,
故答案为:分液漏斗;
(2)根据题干信息可得,制备CH3Cl的化学方程式为CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O,
故答案为:CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O;
(3)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率,
故答案为:增大盐酸的量以提高甲醇的转化率;
(4)用A装置制备CH3Cl,C装置除去挥发出来的HCl,B装置制备氯气,D装置检验氯气的产生,G装置吸收多余的氯气,防止空气污染,
①为验证其氧化产物氯气,选择装置的先后顺序是ACBDG,故答案为:ACBDG;
②连接好装置后,由于氯气有毒,实验前首先进行装置的气密性的检查,故答案为:检查装置的气密性;
③Na2SO3溶液呈碱性,滴有酚酞的溶液为红色,同时Na2SO3具有较强还原性,与强氧化性物质Cl2会被氧化成Na2SO4溶液,装置D的实验现象是溶液红色逐渐褪去,故答案为:溶液红色逐渐褪去.
点评 本题考查了甲醇和浓盐酸混合加热制一氯甲烷的实验原理,涉及实验操作、盐类水解、物质的性质检验及反应原理的探究,综合性较强,但基础性知识偏多,难度不大,离子方程式的书写错误率可能偏高点.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
| A. | 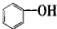 属于醇类化合物 属于醇类化合物 | B. | 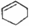 属于芳香族化合物 属于芳香族化合物 | ||
| C. |  属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2 属于链状化合物 |
| A. | 质子数c>d,离子的还原性Y2->Z- | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>X |
实验Ⅰ:将Fe3+转化为Fe2+(图1)
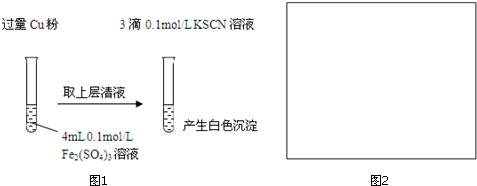
(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓+I2
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO?Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请设计实验方案,并画出实验装置图2,实现
Fe2+$\stackrel{稀HNO_{3}}{→}$Fe3+的转化,同时避免出现此异常现象.
| A. | 常温下,pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CHCOO-) | |
| B. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCl)>Ksp(Ag2CrO4),则AgCl的溶解度大于Ag2CrO4 | |
| D. | 醋酸溶液加少量水稀释$\frac{c(C{H}_{3}COOH)}{C({H}^{+})}$增大 |
| A. | 1 mol NO | B. | 1 mol NO2和0.05 mol O2 | ||
| C. | 2 mol O2 | D. | 0.25 mol O2 |