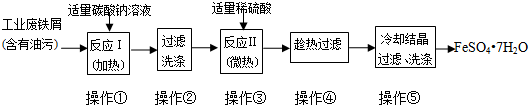
题目内容
4.下列有机物与足量溴水反应,有机物和溴的物质的量之比为1:2的是( )| A. | 2-甲基-2-丁烯 | B. | 2-丁炔 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二炔 |
分析 单烯烃和溴发生加成反应时,二者的物质的量之比为1:1;二烯烃或单炔烃和溴发生完全加成反应时,二者的物质的量之比为1:2;二炔烃和溴发生完全加成反应时,二者的物质的量之比为1:4,据此分析解答.
解答 解:单烯烃和溴发生加成反应时,二者的物质的量之比为1:1;二烯烃或单炔烃和溴发生完全加成反应时,二者的物质的量之比为1:2;二炔烃和溴发生完全加成反应时,二者的物质的量之比为1:4;
有机物与足量溴水反应,有机物和溴的物质的量之比为1:2,说明该烃中含有两个碳碳双键或一个碳碳三键,符合条件的有BC,故选BC.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃和炔烃性质,注意:碳碳不饱和烃和溴发生加成反应时碳碳不饱和键物质的量与溴物质的量的关系,题目难度不大.

练习册系列答案
相关题目
14.按碳骨架分类,下列说法正确的是( )
| A. | 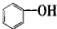 属于醇类化合物 属于醇类化合物 | B. | 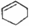 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 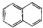 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2 属于链状化合物 |
15.将3mol的NO2气体依次通入下列三个分别装有足量①NaHCO3饱和溶液 ②浓H2SO4 ③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是(同温、同压下测定)( )
| A. | 1 mol NO | B. | 1 mol NO2和0.05 mol O2 | ||
| C. | 2 mol O2 | D. | 0.25 mol O2 |
12.下面的叙述正确的是( )
| A. | 使湿润淀粉-KI试纸变蓝色的气体必为氯气 | |
| B. | 氟气与熔融状态下氯化钠反应可产生氯气 | |
| C. | 易见光分解的AgNO3晶体,应存放于棕色细口试剂瓶中 | |
| D. | 溴水应存放在胶头滴瓶(棕色)中 |
9.茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | 分子式为C4H8O2且官能团与X相同的物质共有5种 | |
| D. | X完全燃烧后生成CO2和H20的物质的量比为1:2. |
2.下列说法正确的是( )
| A. | 由0.1 mol/L一元碱BOH溶液的pH=10,可推知溶液存在BOH=B++OH- | |
| B. | 醋酸溶于水并达到电离平衡后,加水稀释,则溶液中的c(OH-)减小 | |
| C. | pH=3的醋酸加水稀释后,CH3COOH电离程度增大,醋酸电离常数不变 | |
| D. | 醋酸在醋酸钠溶液中的电离程度大于纯水中的电离程度 |
3.三氯化磷(PCl3)是一种重要的有机合成催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示.
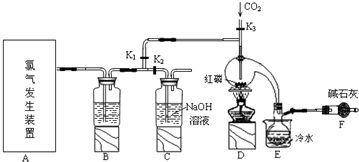
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见下表.
请回答:
(1)写出A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B装置中所盛试剂是浓硫酸;E中烧杯内冷水的作用是冷凝PCl3防止其挥发便于收集产品.
(3)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.其中通入干燥CO2的目的是排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应.
(4)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过蒸馏(填实验名称)即可得到较纯净的PCl3.
(5)实验后关闭K1,打开K2,将A、B中剩余氯气通入300ml 1mol/L的NaOH溶液中.若NaOH恰好完全反应,(假设反应生成了NaCl、NaClO 和 NaClO3 等钠盐),则反应中转移电子的物质的量(n)的范围是0.15mol<n<0.25mol.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见下表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)写出A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B装置中所盛试剂是浓硫酸;E中烧杯内冷水的作用是冷凝PCl3防止其挥发便于收集产品.
(3)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.其中通入干燥CO2的目的是排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应.
(4)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过蒸馏(填实验名称)即可得到较纯净的PCl3.
(5)实验后关闭K1,打开K2,将A、B中剩余氯气通入300ml 1mol/L的NaOH溶液中.若NaOH恰好完全反应,(假设反应生成了NaCl、NaClO 和 NaClO3 等钠盐),则反应中转移电子的物质的量(n)的范围是0.15mol<n<0.25mol.