题目内容
已知酸性:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B、向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C、向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A、能使pH试纸显深红色的溶液是强酸性溶液;
B、溴单质能将亚铁离子氧化为浅黄色的三价铁离子;
C、碳酸酸性强于次氯酸,向NaClO溶液中通入少量二氧化碳能发生反应;
D、还原性Fe2+<I-,氯气先将碘离子氧化.
B、溴单质能将亚铁离子氧化为浅黄色的三价铁离子;
C、碳酸酸性强于次氯酸,向NaClO溶液中通入少量二氧化碳能发生反应;
D、还原性Fe2+<I-,氯气先将碘离子氧化.
解答:
解:A、能使pH试纸显深红色的溶液是强酸性溶液,强酸性溶液中Fe3+、Cl-、Ba2+、Br-能大量共存,故A正确;
B、氧化性:Br2>Fe3+,向溴水中加入足量氯化亚铁溶液溴单质能将亚铁离子氧化为浅黄色的三价铁离子,故B错误;
C、碳酸酸性强于次氯酸,向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-,故C错误;
D、还原性Fe2+<I-,向碘化亚铁中滴加少量氯水,氯气先将碘离子氧化,后氧化亚铁离子,故D错误.
故选A.
B、氧化性:Br2>Fe3+,向溴水中加入足量氯化亚铁溶液溴单质能将亚铁离子氧化为浅黄色的三价铁离子,故B错误;
C、碳酸酸性强于次氯酸,向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-,故C错误;
D、还原性Fe2+<I-,向碘化亚铁中滴加少量氯水,氯气先将碘离子氧化,后氧化亚铁离子,故D错误.
故选A.
点评:本题考查了离子共存、离子方程式的书写,要注意反应的先后顺序问题,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
V mL硫酸铝溶液中含有mg SO42-,则Al3+的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列选项正确的是( )
| A、向FeBr2溶液中通入少量的氯气:Cl2+2Br-=2Cl-+Br2 |
| B、大理石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、使石蕊呈蓝色的溶液中,可能存在大量的:Na+、AlO2-、NO3-、HCO3- |
| D、加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- |
N2和H2合成1molNH3时可放出46.2kJ/mol的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是( )
| A、.391.6 kJ/mol |
| B、1174.7kJ/mol |
| C、.700.2kJ/mol |
| D、.541.4kJ/mol |
能正确表示下列反应的离子方程式是( )
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
下列说法正确的是( )
| A、干馏煤可以得到甲烷、苯和氨等重要化工原料 |
| B、油脂、乙醇是人体所必须的营养物质 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、为推广氢能的使用,工业上可采用电解水法制取大量氢气 |
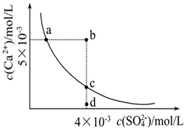 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
| A、常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中无沉淀析出 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C、d点溶液通过蒸发可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |