题目内容
8.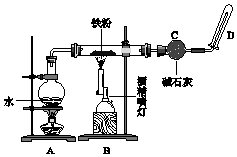 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.(1)装置A的作用是制水蒸气.
(2)B中反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)碱石灰的作用是干燥氢气.
(4)在D处玻璃管口点燃生成的气体前,必须对该气体进行验纯,这一操作的目的是防止点燃时,氢气因含有氧气而爆炸.
(5)当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是8.96 L.
分析 (1)铁与水蒸气反应,则装置A的作用是制水蒸气;
(2)铁与水蒸气反应,生成四氧化三铁和氢气;
(3)生成的气体用碱石灰吸收;
(4)点燃氢气前一定要检验纯度,防止发生爆炸;
(5)根据铁与水蒸气反应,生成四氧化三铁和氢气计算.
解答 解:(1)铁与水蒸气反应,则装置A的作用是制水蒸气,故答案为:制水蒸气;
(2)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2,方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)最后生成的气体为氢气,干燥氢气可以用碱石灰,故答案为:干燥氢气;
(4)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸.故答案为:验纯;防止点燃时,氢气因含有氧气而爆炸;
(5)根据3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,则当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是$\frac{16.8}{56}$×$\frac{4}{3}$×22.4=8.96L,故答案为:8.96.
点评 本题为铁及其化合物的性质实验,难度不大,要掌握装置气密性的方法及检验气体纯度的方法.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
20.下列说法正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 50℃时,NH4Cl和HCl的混合液中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
16.下列有关卤素单质及其化合物的说法正确的是( )
| A. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| B. | 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大 | |
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 | |
| D. | 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
3.下列方案中,依照相应实验药品及图示装置进行实验,能达到相应实验目的是( )
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |
13.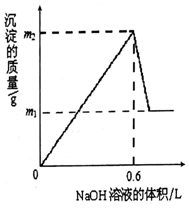 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
18.将某文献资料上记载的相对原子质量数据摘录如表:
试回答下列问题:(1)34.969表示同位素35Cl相对原子质量 (2)35.485是表示氯元素的近似相对原子质量.
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.969 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
 .
.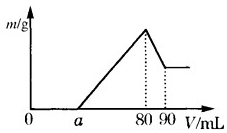 (1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
(1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: