题目内容
在 MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O反应中,
(1) 是氧化剂.若生成142g Cl2,则消耗的HCl是 mol.
(2)被氧化的HCl与参加反应的HCl物质的量之比是 .
(3)该反应的离子方程式是 .
(4)用双线桥标出该反应电子转移的方向和数目:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
| ||
(1)
(2)被氧化的HCl与参加反应的HCl物质的量之比是
(3)该反应的离子方程式是
(4)用双线桥标出该反应电子转移的方向和数目:MnO2+4HCl(浓)
| ||
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)该反应中Mn元素化合价由+4价变为+2价,部分Cl元素化合价由-1价变为0价,根据氯气和氯化氢之间的关系式计算;
(2)该反应中被氧化的和参加反应的HCl的物质的量之比为1:2;
(3)氧化物、单质和弱电解质写化学式;
(4)该反应中Mn元素化合价由+4价变为+2价,部分Cl元素化合价由-1价变为0价,转移电子数为2.
(2)该反应中被氧化的和参加反应的HCl的物质的量之比为1:2;
(3)氧化物、单质和弱电解质写化学式;
(4)该反应中Mn元素化合价由+4价变为+2价,部分Cl元素化合价由-1价变为0价,转移电子数为2.
解答:
解:(1)该反应中Mn元素化合价由+4价变为+2价,部分Cl元素化合价由-1价变为0价,所以MnO2是氧化剂,氯气的物质的量=
=2mol,生成氯气和消耗HCl的物质的量之比为1:4,所以消耗HCl的物质的量=4×2mol=4mol,故答案为:MnO2;8;
(2)该反应中被氧化的和参加反应的HCl的物质的量之比为1:2,故答案为:1:2;
(3)氧化物、单质和弱电解质写化学式,该反应离子方程式为MnO2+4H++2Cl-(浓)
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-(浓)
Mn2++Cl2↑+2H2O;
(4)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为: ,故答案为:
,故答案为: .
.
| 142g |
| 71g/mol |
(2)该反应中被氧化的和参加反应的HCl的物质的量之比为1:2,故答案为:1:2;
(3)氧化物、单质和弱电解质写化学式,该反应离子方程式为MnO2+4H++2Cl-(浓)
| ||
| ||
(4)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为:
 ,故答案为:
,故答案为: .
.
点评:本题考查了氧化还原反应,根据元素化合价变化确定氧化剂和还原剂,难点是标出电子转移的方向和数目,题目难度不大.

练习册系列答案
相关题目
有关2L 0.1mol?L-1的K2SO4溶液的叙述正确的是( )
| A、K+的物质的量为0.1mol | ||
B、倒出1 L溶液后,浓度变为原来的
| ||
| C、K+的物质的量浓度为0.1mol/L | ||
| D、含有0.2mol K2SO4 |
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、Z的说法正确的是( )


| A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
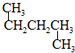 和
和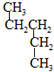
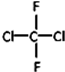 和
和 ⑦CH3CH2CH2CH3和
⑦CH3CH2CH2CH3和