题目内容
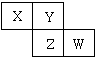
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、Z的说法正确的是( )


| A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据“短周期”元素X、Y、Z在元素周期表中的相对位置,可确定X为He元素、Y为F元素、Z为S元素,结合元素周期律及元素化合物性质解答.
解答:
解:根据“短周期”元素X、Y、Z在元素周期表中的相对位置,可确定X为He元素、Y为F元素、Z为S元素,
A.He与氢气不反应,故A错误;
B.由氢、氧和S元素形成的常见化合物为硫酸、亚硫酸,属于共价化合物,只有含有共价键,不含离子键,故B错误;
C.二氧化硫与硫酸不反应,故C错误;
D.非金属性F>S,故氢化物稳定性HF>H2S,故D正确,
故选D.
A.He与氢气不反应,故A错误;
B.由氢、氧和S元素形成的常见化合物为硫酸、亚硫酸,属于共价化合物,只有含有共价键,不含离子键,故B错误;
C.二氧化硫与硫酸不反应,故C错误;
D.非金属性F>S,故氢化物稳定性HF>H2S,故D正确,
故选D.
点评:本题考查位置结构性质的相互关系应用,题目难度不大,注意周期律的递变规律与元素周期表的整体结构.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
对于Cl2+SO2+2H2O═H2SO4+2HCl反应,下列说法正确的是( )
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应 ⑤SO2具有还原性 ⑥Cl2具有氧化性.
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应 ⑤SO2具有还原性 ⑥Cl2具有氧化性.
| A、只有①②⑥ |
| B、只有②③④ |
| C、只有②④⑤⑥ |
| D、只有①②④⑤⑥ |
在以下各种情形下,下列电离方程式或离子方程式书写正确的是( )
| A、熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- |
| B、H2CO3的电离:H2CO3?2H++CO32- |
| C、Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- |
| D、Na2CO3的水解:CO32-+2H2O?H2CO3+2OH- |
某有机物的结构简式如图所示,下列说法错误的是( )


| A、该物质能和氯化铁溶液发生显色反应 |
| B、该物质含有两种含氧官能团 |
| C、该物质可使溴的四氯化碳溶液褪色 |
| D、该物质既可以发生取代反应又可以发生加成反应 |
2.8g铁与0.1L稀硝酸混合后充分反应,产生气体为NO,反应后Fe、硝酸均无剩余.向反应后的溶液中加入0.1L 0.2mol/LKI溶液,恰好将溶液中的Fe3+全部还原.则原溶液硝酸的物质的量浓度为( )
| A、1.2mol/l |
| B、1.6mol/l |
| C、2mol/l |
| D、1.3mol/l |
 如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子最外电子层电子数是其内层电子数的
如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子最外电子层电子数是其内层电子数的| 7 |
| 10 |
| A、X元素的氢化物水溶液呈碱性 |
| B、气态氢化物的稳定性:Y>Z |
| C、最高氧化物对应水化物的酸性:W>Z |
| D、阴离子半径从大到小排列的顺序:Y>Z>W |
不属于氧化还原反应的是( )
A、2Al+Fe2O3
| ||||
B、2Mg+CO2
| ||||
C、N2+3H2
| ||||
| D、CaO+H2O═Ca(OH)2 |