题目内容
有X、Y、Z、W四种元素,已知:(1)它们都是短周期元素,X和Z在同一周期;在常温下W元素的单质是黄绿色气体(2)它们可以组成:X2Z、ZY2、ZY3 化合物;(3)ZY3与水化合生成一种强酸,此强酸与X2Z反应可生成一种气体A.根据以上推断回答下列问题:
(1)X、Y、Z、W四种元素的元素符号依次为:
(2)画出 z2-的结构示意图:
(3)用电子式表示 X2Z 的形成过程: ,用电子式表示气体A的形成过程:
(4)ZY3与水化合生成的强酸与X2Z反应的化学方程式为:
(5)A和W元素的单质反应的化学反应方程式是:
(6)w的最高价氧化物溶于水得到一种稀溶液,写出该反应的化学反应方程式: .
(1)X、Y、Z、W四种元素的元素符号依次为:
(2)画出 z2-的结构示意图:
(3)用电子式表示 X2Z 的形成过程:
(4)ZY3与水化合生成的强酸与X2Z反应的化学方程式为:
(5)A和W元素的单质反应的化学反应方程式是:
(6)w的最高价氧化物溶于水得到一种稀溶液,写出该反应的化学反应方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:有X、Y、Z、W四种元素,它们都是短周期元素,在常温下W元素的单质是黄绿色气体,则W为Cl元素;它们可以组成:X2Z、ZY2、ZY3 化合物,而ZY3与水化合生成一种强酸,应是SO3与水反应生成硫酸,可推知Y为O、Z为S,X和Z在同一周期,由形成的化合物可知X为+1价,则X为Na,硫酸与Na2S反应可生成一种气体A为H2S,验证符合题意,据此解答.
解答:
解:有X、Y、Z、W四种元素,它们都是短周期元素,在常温下W元素的单质是黄绿色气体,则W为Cl元素;它们可以组成:X2Z、ZY2、ZY3 化合物,而ZY3与水化合生成一种强酸,应是SO3与水反应生成硫酸,可推知Y为O、Z为S,X和Z在同一周期,由形成的化合物可知X为+1价,则X为Na,硫酸与Na2S反应可生成一种气体A为H2S,验证符合题意,
(1)由上述分析可知,X、Y、Z、W四种元素的元素符号依次为:Na、O、S、Cl,
故答案为:Na、O、S、Cl;
(2)S2-离子核外有18个电子层,有3个电子层,各层电子数为2、8、8,结构示意图为: ,
,
故答案为: ;
;
(3)用电子式表示 Na2S 的形成过程为: ,用电子式表示气体H2S的形成过程为:
,用电子式表示气体H2S的形成过程为: ,
,
故答案为: ;
; ;
;
(4)硫酸与Na2S反应生成硫酸钠与硫化氢,化学方程式为:H2SO4+Na2S=Na2SO4+H2S↑,
故答案为:H2SO4+Na2S=Na2SO4+H2S↑;
(5)硫化氢与氯气反应生成S与HCl,化学反应方程式是:H2S+Cl2=S↓+2HCl,
故答案为:H2S+Cl2=S↓+2HCl;
(6)W的最高价氧化物为Cl2O7,溶于水得到高氯酸,化学反应方程式为:Cl2O7+H2O=2HClO4,
故答案为:Cl2O7+H2O=2HClO4.
(1)由上述分析可知,X、Y、Z、W四种元素的元素符号依次为:Na、O、S、Cl,
故答案为:Na、O、S、Cl;
(2)S2-离子核外有18个电子层,有3个电子层,各层电子数为2、8、8,结构示意图为:
 ,
,故答案为:
 ;
;(3)用电子式表示 Na2S 的形成过程为:
 ,用电子式表示气体H2S的形成过程为:
,用电子式表示气体H2S的形成过程为: ,
,故答案为:
 ;
; ;
;(4)硫酸与Na2S反应生成硫酸钠与硫化氢,化学方程式为:H2SO4+Na2S=Na2SO4+H2S↑,
故答案为:H2SO4+Na2S=Na2SO4+H2S↑;
(5)硫化氢与氯气反应生成S与HCl,化学反应方程式是:H2S+Cl2=S↓+2HCl,
故答案为:H2S+Cl2=S↓+2HCl;
(6)W的最高价氧化物为Cl2O7,溶于水得到高氯酸,化学反应方程式为:Cl2O7+H2O=2HClO4,
故答案为:Cl2O7+H2O=2HClO4.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,注意掌握用电子式表示化学键或物质的形成过程,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:
2CrO42-(黄色)+2H +?Cr2O72-(橙色)+H2O若要使溶液的橙色加深,下列可采用的方法是( )
2CrO42-(黄色)+2H +?Cr2O72-(橙色)+H2O若要使溶液的橙色加深,下列可采用的方法是( )
| A、加入适量烧碱固体 |
| B、加入适量稀盐酸 |
| C、加入适量稀硫酸 |
| D、加水稀释 |
对于Cl2+SO2+2H2O═H2SO4+2HCl反应,下列说法正确的是( )
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应 ⑤SO2具有还原性 ⑥Cl2具有氧化性.
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应 ⑤SO2具有还原性 ⑥Cl2具有氧化性.
| A、只有①②⑥ |
| B、只有②③④ |
| C、只有②④⑤⑥ |
| D、只有①②④⑤⑥ |
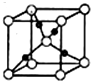 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得铜锰氧化物CuMn2O4.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.
向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得铜锰氧化物CuMn2O4.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.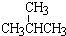 和
和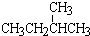 ;②正戊烷和
;②正戊烷和 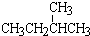 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)