题目内容
10. (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-═4OH-.
负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑.
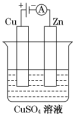
(3)如图是一个电化学过程示意图.①锌片上发生的电极反应式是Cu2++2e-=Cu.
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼-空气燃料电池理论上消耗标准状况下的空气112 L(假设空气中氧气体积含量为20%).
(4)传统制备肼的方法,是用NaClO氧化NH3制得肼的稀溶液.该反应的离子方程式是ClO-+2NH3=N2H4+Cl-+H2O.
分析 (1)32.0g N2H4的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol联氨和双氧水反应生成氮气和液体水放出热量642kJ,据此书写热化学反应方程式;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,正极上是氧气得到电子生成氢氧根离子;
(3)①装置为电解池,锌和电源负极相连为电解池的阴极,溶液中铜离子得到电子生成铜;
②根据电极反应,结合电子守恒和空气的组成情况来回答;
(4)NaClO氧化NH3可以制得肼,还生成氯化钠.
解答 解:(1)32.0g N2H4的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol联氨和双氧水反应生成氮气和液态水放出热量642kJ,其热化学反应方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol;
(2)肼-氧气碱性燃料电池中,正极上氧气得到电子法还原反应生成氢氧根离子,电极反应为:O2+2H2O+4e-═4OH-,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,
故答案为:O2+2H2O+4e-═4OH-; N2H4+4OH--4e-═4H2O+N2↑
(3)①装置为电解池,锌和电源负极相连为电解池的阴极,溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,
故答案为:112;
(4)NaClO氧化NH3可以制得肼的离子方程式为:ClO-+2NH3=N2H4+Cl-+H2O,
故答案为:ClO-+2NH3=N2H4+Cl-+H2O.
点评 本题是一道有关热化学和电化学知识的综合考察知识题目,要求学生具有分析和解决问题的能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | Y<X<Z |
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| A. | 1:25 | B. | 1:55 | C. | 1:5 | D. | 1:100 |