题目内容
20.0.1mol Na2CO3•10H2O溶于180g水中,溶液中Na+和H2O个数之比约为( )| A. | 1:25 | B. | 1:55 | C. | 1:5 | D. | 1:100 |
分析 根据n=$\frac{m}{M}$可计算出180g水的物质的量,然后计算出0.1mol Na2CO3•10H2O中含有钠离子、水分子的物质的量,从而可知溶液中Na+和H2O的物质的量之比,个数之比就等于其物质的量之比.
解答 解:0.1mol Na2CO3•10H2O中含有钠离子的物质的量为:0.1mol×2=0.2mol,含有水分子的物质的量为:0.1mol×10=1mol;
180g水的物质的量为:$\frac{180g}{18g/mol}$=10mol,
则该溶液中含有水的总物质的量为:1mol+10mol=11mol,
微粒个数之比等于其物质的量之比,所以溶液中Na+和H2O个数之比为:0.2mol:11mol=1::5,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
11.同温度同浓度的下列四种溶液①NaF ②CH3COONa ③NaHCO3 ④NaHS,其pH大小顺序正确的是(已知酸性:HF>CH3COOH>H2CO3>H2S)( )
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③>①>② | D. | ①>④>③>② |
15.有关金属性质的叙述正确的是( )
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol. 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):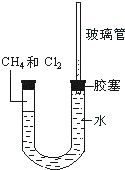 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.