题目内容
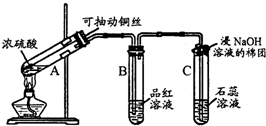
13.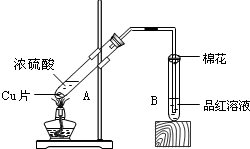 某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:
某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:Ⅰ.写出A中发生反应的方程式Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O若A中有1mol Cu与2mol浓硫酸充分反应,则生成气体的物质的量为小于1mol.
Ⅱ.B试管管口堵的棉花可以事先用下列①③试剂浸泡(填序号).
①性高锰酸钾溶液 ②浓硫酸 ③NaOH溶液.
分析 I.加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水;Cu与浓硫酸反应与稀硫酸不反应;
II.生成的二氧化硫有毒,是大气污染物,所以要进行处理,利二氧化硫为酸性还原性气体.
解答 解:I.加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;Cu与浓硫酸反应与稀硫酸不反应,1mol Cu与2mol浓硫酸充分反应硫酸不能全部反应,生成气体的物质的量小于1mol;
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;小于1;
II.生成的二氧化硫有毒,是大气污染物,所以要进行处理,利二氧化硫为酸性还原性气体,酸性选③,还原性选①,
故答案为:①③.
点评 本题考查了Cu与浓硫酸的反应、二氧化硫的性质,题目难度不大,侧重于考查学生分析能力和实验能力,注意把握实验原理和尾气处理原理.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
1.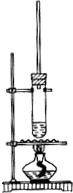 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )| A. | 为了控制温度可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯可用饱和碳酸钠溶液洗涤 |
 mol的硫
mol的硫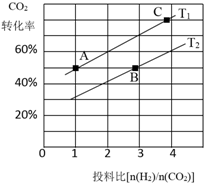 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.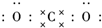 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.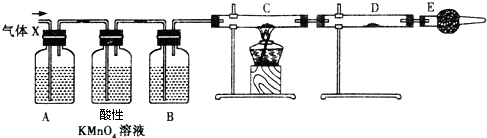
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O; >Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
>Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+