题目内容
已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A.Cl2 >Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
>Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.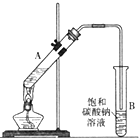 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
有关数据及副反应:
副反应:
C2H5OH+C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$\stackrel{△}{→}$CH3COOCH2CH3+H2O.
 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
C2H5OH+C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$\stackrel{△}{→}$CH3COOCH2CH3+H2O.
12.某温度下,有一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)?4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
9.工业上真空炼铷的原理为2RbCl+Mg$\frac{\underline{\;熔融\;}}{\;}$MgCl2+2Rb(g),下列说法正确的是( )
| A. | 镁的金属活动性比铷强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性比RbCl弱 | |
| D. | Rb单质比RbCl更稳定 |
10.下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是( )
| A. | 卫生纸 | B. | 电池 | C. | 纯棉纺织品 | D. | 农用塑料薄膜 |


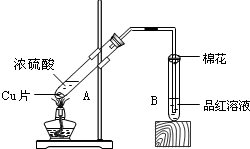 某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:
某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答: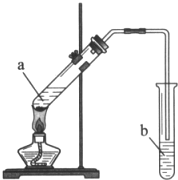 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.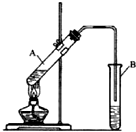 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.