题目内容
5.根据如图所示实验回答下列问题: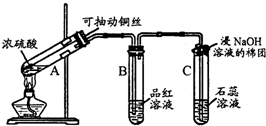
(1)试管A中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,试管C口部的棉团中发生反应的离子方程式是SO2+2OH -═SO32-+H2O
(2)试管B中的实验现象是品红溶液褪色,若将该试管中反应后的溶液加热,可以观察到试管B中的实验现象是褪色后的品红溶液变红,通过试管C中的实验现象,可以证明SO2是酸性氧化物.(填“酸性”,“碱性”或“两性”)
分析 (1)A中浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水;C试管口二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫漂白性具有不稳定性;酸性氧化物与水反应生成对应酸,酸能够使石蕊变红色.
解答 解:(1)A中浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
C试管口二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水,离子方程式:SO2+2OH-=SO32-+H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2OH-=SO32-+H2O;
(2)浓硫酸与铜反应生成二氧化硫,二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫漂白性具有不稳定性,所以若将该试管B中反应后的溶液加热,可以观察到试管B中的实验现象是:褪色后的品红溶液变红;二氧化硫与水反应生成亚硫酸,亚硫酸具有酸性,能够使石蕊变红色,可证明二氧化硫为酸性氧化物;
故答案为:品红溶液褪色;褪色后的品红溶液变红;酸性.
点评 本题考查了铜与浓硫酸反应的实验及产物验证,明确反应实质及产物的性质是解题关键,注意二氧化硫漂白性特点及酸性氧化物的性质,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
10.某研究性学习小组做铜与浓硫酸反应的探究实验:
①加热过程中发现试管底部有黑色颗粒状物质,后来逐渐转变为灰白色固体;
②倒去试管中的液体后,将残余固体(表面含有少量浓硫酸)倒入少量水中,发现溶液变蓝;并有黑色固体残余;③将②残余黑色固体过滤、洗涤后,向黑色固体中加入过量浓硝酸并加热,固体溶解,溶液变蓝;
④向③所得溶液中加入BaCl2溶液有白色沉淀产生.
下列结论不正确的是( )
①加热过程中发现试管底部有黑色颗粒状物质,后来逐渐转变为灰白色固体;
②倒去试管中的液体后,将残余固体(表面含有少量浓硫酸)倒入少量水中,发现溶液变蓝;并有黑色固体残余;③将②残余黑色固体过滤、洗涤后,向黑色固体中加入过量浓硝酸并加热,固体溶解,溶液变蓝;
④向③所得溶液中加入BaCl2溶液有白色沉淀产生.
下列结论不正确的是( )
| A. | 铜与浓硫酸反应生成的白色固体是CuSO4 | |
| B. | ①中灰白色固体不可能含有CuO | |
| C. | ②中的黑色固体可能含有CuS或Cu2S | |
| D. | ④中所得的白色沉淀是BaSO3 |
17. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.7×10-7,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.
(3)已知反应2HI(g)?H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299 kJ.
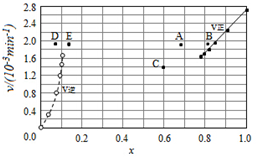
(4)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.108×0.108}{0.78{4}^{2}}$;
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.7×10-7,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.
(3)已知反应2HI(g)?H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299 kJ.
(4)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).
12.某温度下,有一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)?4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是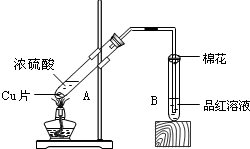 某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:
某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答: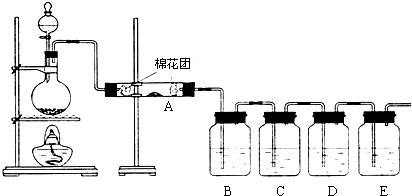
 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.