题目内容
16.二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,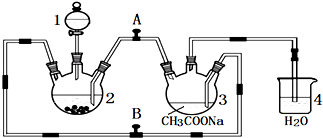
制备过程中发生的反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g);
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O (s)
请回答下列问题:
(1)仪器1的名称是分液漏斗,所盛装的试剂是盐酸.
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是去除水中的溶解氧,防止Cr2+被氧化.
(3)装置4的主要作用是防止空气进入装置3.
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应打开阀门A关闭阀门B (填“打开”或“关闭”).
(5)本实验中锌粒须过量,其原因是与CrCl3充分反应得到CrCl2;产生足量H2,将CrCl2溶液压入装置3与CH3COONa溶液反应.
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 5.64g,则该实验所得产品的产率为75%.
分析 (1)依据装置图形状和作用分析,仪器1为分液漏斗,盛装稀盐酸;
(2)配制用的蒸馏水都需事先煮沸,防止氧气氧化Cr2+;
(3)装置4是保持装置压强平衡,同时避免空气进入;
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开A关闭B,把生成的CrCl2溶液压入装置3中反应;
(5)锌的作用是和盐酸反应生成氢气,增大仪器中的压强把生成的CrCl2溶液压入装置3,与CrCl3充分反应得到CrCl2;
(6)依据化学方程式定量关系计算分析,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)根据仪器1的构造可知其名称为分液漏斗,盛装的稀盐酸与锌反应生成氢气,用来增大压强把生成的CrCl2溶液压入装置3中,
故答案为:分液漏斗;盐酸;
(2)由于二价铬不稳定,极易被氧气氧化,需要将配制用的蒸馏水事先煮沸,去除水中的溶解氧,防止Cr2+被氧化,
故答案为:去除水中的溶解氧,防止Cr2+被氧化;
(3)二价铬不稳定,极易被氧气氧化,装置4的主要作用是防止空气进入装置3,
故答案为:防止空气进入装置3;
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开A关闭B,把生成的CrCl2溶液压入装置3中反应,
故答案为:打开;关闭;
(5)锌的作用是和盐酸反应生成氢气,增大仪器中的压强把生成的CrCl2溶液压入装置3,与CrCl3充分反应得到CrCl2,
故答案为:与CrCl3充分反应得到CrCl2; 产生足量的H2,将CrCl2溶液压入装置3与CH3COONa溶液反应;
(6)实验时取用的CrCl3溶液中含溶质6.34g,
理论上得到[Cr(CH3COO)2]2•2H2O 的质量为:$\frac{6.34g}{158.5g/mol}$×$\frac{1}{2}$×376g/mol=7.52g,
则该实验所得产品的产率为:$\frac{5.64g}{7.52g}$×100%=75%,
故答案为:75%.
点评 本题考查了物质制备实验装置分析判断,实验设计方法和物质性质的理解应用,主要是实验原理的分析应用,掌握基础是关键,题目难度中等,明确实验目的、实验原理为解答关键.

 阅读快车系列答案
阅读快车系列答案 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
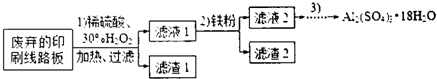
(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净.
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:
2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用Na2S2O3标准溶液润洗2~3次.
②滴定终点观察到的现象为溶液蓝色恰好褪去,且半分钟内不恢复.
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:滤液2$→_{过滤}^{适量Al粉}$滤液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
乙:滤液2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
①操作③的实验步骤依次为:蒸发浓缩:冷却结晶、过滤、洗涤.
②从原子利用率角度考虑,甲方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
②调节溶液pH约为3.2~3.8.
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度正反应速率加快 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
(2)指出实验②和实验③中的“实验现象”:
②有色布条褪色;③有气泡生成
(3)实验②的“实验现象”,同学们得出两个不同的结论.这两个结论可能是
a.Cl2具有漂白性,b.HClO具有漂白性.
请设计简单的实验证明哪一个是正确的用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①③实验无影响.
| A. | ①③ | B. | ③⑤ | C. | ①⑤ | D. | ②⑥ |
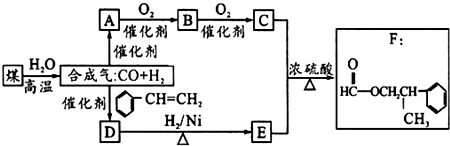
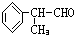
 .
. 、
、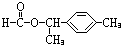 .
.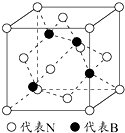 利用所学化学知识解答问题:
利用所学化学知识解答问题: