题目内容
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、在常温常压下,11.2L N2含有的分子数为0.5NA |
| B、在常温常压下,1mol H2含有的原子数为2NA |
| C、71g Cl2的体积约为22.4L |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据气体摩尔体积的应用条件分析判断;
B、原子数=分子物质的量×原子数×NA;
C、依据n=
计算物质的量,温度压强不知不能计算气体体积;
D、依据阿伏伽德罗定律分析判断,气体可以是原子、分子构成分析;
B、原子数=分子物质的量×原子数×NA;
C、依据n=
| m |
| M |
D、依据阿伏伽德罗定律分析判断,气体可以是原子、分子构成分析;
解答:
解:A、依据气体摩尔体积的应用条件分析,在常温常压下,11.2L N2含物质的量不是0.5mol,故A错误;
B、原子数=分子物质的量×原子数×NA,1mol H2含有的原子数为2NA,故B正确;
C、依据n=
计算物质的量,温度压强不知不能计算气体体积,故C错误;
D、依据阿伏伽德罗定律分析判断,气体可以是原子、分子构成,在同温同压下,相同体积的任何气体单质所含的分子数相同,原子数不一定相同,故D错误;
故选B.
B、原子数=分子物质的量×原子数×NA,1mol H2含有的原子数为2NA,故B正确;
C、依据n=
| m |
| M |
D、依据阿伏伽德罗定律分析判断,气体可以是原子、分子构成,在同温同压下,相同体积的任何气体单质所含的分子数相同,原子数不一定相同,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积的条件应用,阿伏伽德罗定律的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
下列离子方程式正确的是( )
| A、漂白粉溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
| B、将0.5molCl2通入含1molFeBr2的溶液中:Cl2+2Fe2+=2Fe3++2Cl- |
| C、碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
下列热化学方程式书写正确的是( )
A、2SO2+
| ||||
| B、4H2(g)+2O2-4H2O(1)△H=-1143.2kJ?mol-! | ||||
| C、C(s)+O2(g)=CO2(g)△H=393.5kJ | ||||
| D、C(s)+O2(g)=CO2(g)△H=393.5kJ?mol-! |
铁和铁合金是生活中常用的材料,下列说法正确的是( )
| A、不锈钢是铁合金,只含金属元素 |
| B、一定条件下,铁粉可与水蒸气反应 |
| C、铁与盐酸反应,铁合金不与盐酸反应 |
| D、铁合金的硬度和强度均低于铁 |
下列各组物质中,化学键的类型(离子键、共价键)相同的是( )
| A、CO和MgCl2 |
| B、NH4F和NaF |
| C、Na2O2和H2O2 |
| D、H2O和SO2 |
下列说法不正确的是( )
| A、多孔碳可用作氢氧燃料电池的电极材料 |
| B、油脂的皂化反应生成脂肪酸和丙醇 |
| C、盐析可提纯蛋白质并保持其生理活性 |
| D、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子(NA表示阿伏加德罗常数) |
下列金属的冶炼适宜用热还原法冶炼的是( )
| A、钠 | B、铝 | C、汞 | D、铁 |
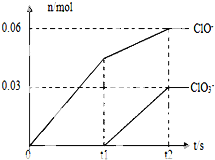 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、苛性钾溶液中KOH的物质的量是0.09mol |
| B、ClO3-的生成是由于氯气的量的多少引起的 |
| C、在酸性条件下,ClO-和ClO3-可生成Cl2 |
| D、反应中转移电子的物质的量是0.21mol |
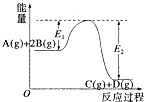 反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )
反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )| A、Q=E2 |
| B、在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
| C、Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 |
| D、1molA(g)和2molB(g)具有的能量比1molC(g)和1molD(g)具有的能量低 |