题目内容
下列金属的冶炼适宜用热还原法冶炼的是( )
| A、钠 | B、铝 | C、汞 | D、铁 |
考点:金属冶炼的一般原理
专题:金属概论与碱元素
分析:金属活动顺序表中:铝及铝前的金属用熔盐电解法,这类金属在自然界一般都是亲氧的,绝大多数以含氧酸盐形式存在,少数也以氧化物形式存在;通常要转化为熔点较低的卤化物再进行熔盐电解(铝除外,因为其熔融卤化物不导电,氟化物可导电却毒性超大,常采用电解熔融的三氧化二铝);锌到铜一般用热还原法,这类金属氧化物稳定性高,受热难分解,需要用还原剂,因此用热还原法.在自然界中既有氧化物形式存在,又有硫化物矿存在;若是硫化物矿,则需要煅烧成氧化物,回收副产品SO2.铜后金属用热分解法,这类金属氧化物不稳定,受热易分解,在自然界一般以硫化物矿形式存在,直接煅烧硫化物就可以得到金属,同时生成副产物SO2.
解答:
解:金属的冶炼一般有电解法、热还原法、热分解法、物理分离法,金属活动顺序表中的金属冶炼:活泼金属K、Ca、Na、Mg、AI一般用电解熔融的氯化物(AI是电解熔融的三氧化二铝)制得;较不活泼的金属Zn、Fe、Sn、Pb、Cu等用热还原法制得,常用还原剂有(C、CO、H2等);Hg、Ag用加热分解氧化物的方法制得,Pt、Au用物理分离的方法制得,所以Fe通常采用热还原法冶炼,
故选D.
故选D.
点评:本题主要考查常见金属一般的工业冶炼方法,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 图中,两电极上发生的电极反应分别为:a极:Ag++e-=Ag;b极:Fe-2e-=Fe2+下列说法不正确的是( )
图中,两电极上发生的电极反应分别为:a极:Ag++e-=Ag;b极:Fe-2e-=Fe2+下列说法不正确的是( )| A、a、b可能是同种电极材料 |
| B、该装置一定是电解池 |
| C、装置中电解质溶液一定含有Ag+ |
| D、装置中发生的反应方程式一定是Fe+2Ag+═Fe2++2Ag |
对于反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是( )
A、K=
| ||
B、K=
| ||
| C、增大c(H2O)或减小c(H2),会使该反应平衡常数减小 | ||
| D、改变反应的温度,平衡常数不一定变化 |
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、在常温常压下,11.2L N2含有的分子数为0.5NA |
| B、在常温常压下,1mol H2含有的原子数为2NA |
| C、71g Cl2的体积约为22.4L |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
下列对酒精灯的使用方法的叙述错误的是( )
| A、加入酒精不超过容积的2/3 |
| B、可以用嘴吹灭火焰 |
| C、不用时须盖上灯帽 |
| D、禁止向燃着的酒精灯里添加酒精 |
下列离子方程式书写正确的是( )
| A、少量的金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、铝片投入稀盐酸中:Al+6H+═Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
| D、氧化铝溶于烧碱溶液:Al2O3+2OH-═AlO2-+H2O |
下列推断正确的是( )
| A、Na2O和Na2O2组成元素相同,与CO2反应产物也相同 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、NO和NO2的密度均比空气大,都可用向上排空气法收集 |
| D、C3H8和CH3CH2OH相对分子质量相近,分子间作用力相近,二者沸点也相近 |
有关实验操作或实验突发事件处理正确的是( )
| A、用10mL量筒量取8.58mL蒸馏水 |
| B、将氢氧化钠固体直接放在称量纸上称量 |
| C、中和滴定时,滴定管用蒸馏水洗净后直接装入标准盐酸溶液 |
| D、不慎将苯酚溶液沾到皮肤上,立即用酒精清洗 |
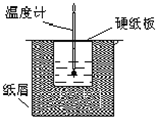 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: