题目内容
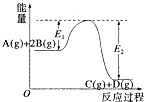 反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )
反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )| A、Q=E2 |
| B、在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
| C、Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 |
| D、1molA(g)和2molB(g)具有的能量比1molC(g)和1molD(g)具有的能量低 |
考点:反应热和焓变,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:A、反应热=反应物的总键能-生成物的总键能;
B、催化剂使正逆反应的活化能都降低;
C、升高温度,平衡向吸热方向移动;
D、根据图象判断反应物总能量与生成物总能量相对大小.
B、催化剂使正逆反应的活化能都降低;
C、升高温度,平衡向吸热方向移动;
D、根据图象判断反应物总能量与生成物总能量相对大小.
解答:
解:A、反应热=反应物的总键能-生成物的总键能,则-Q=E1-E2,故A错误;
B、催化剂使正逆反应的活化能都降低,反应速率加快,则E1减小,E2减小,故B错误;
C、Q>0,则该反应为放热反应,升高温度,平衡向吸热方向移动,所以平衡向逆方向移动,A的浓度增大,故C正确;
D、由图象可知,该反应为放热反应,则反应物总能量大于生成物总能量,即1molA(g)和2molB(g)具有的能量比1molC(g)和1molD(g)具有的能量高,故D错误.
故选C.
B、催化剂使正逆反应的活化能都降低,反应速率加快,则E1减小,E2减小,故B错误;
C、Q>0,则该反应为放热反应,升高温度,平衡向吸热方向移动,所以平衡向逆方向移动,A的浓度增大,故C正确;
D、由图象可知,该反应为放热反应,则反应物总能量大于生成物总能量,即1molA(g)和2molB(g)具有的能量比1molC(g)和1molD(g)具有的能量高,故D错误.
故选C.
点评:本题考查了反应热和焓变的分析判断,图象分析是解题关键,理解反应热的计算方法,注意知识积累,题目较简单.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、在常温常压下,11.2L N2含有的分子数为0.5NA |
| B、在常温常压下,1mol H2含有的原子数为2NA |
| C、71g Cl2的体积约为22.4L |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
有关实验操作或实验突发事件处理正确的是( )
| A、用10mL量筒量取8.58mL蒸馏水 |
| B、将氢氧化钠固体直接放在称量纸上称量 |
| C、中和滴定时,滴定管用蒸馏水洗净后直接装入标准盐酸溶液 |
| D、不慎将苯酚溶液沾到皮肤上,立即用酒精清洗 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol Na2O2固体中含离子总数为4NA | ||
| B、标准状况下,22.4L己烷中共价键数目为19NA | ||
| C、由乙烯和环己烷组成的混合物28g,含电子数为16NA | ||
D、1L浓度为1mol/L的Na2CO3溶液中含有的
|
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A、NH4+ NO3- CO32- Na+ |
| B、Na+ Ba2+ Mg2+ HCO3- |
| C、Cu2+ Fe3+ K+ Cl- |
| D、NO3- K+ AlO2- H+ |
实验室的钠着火燃烧时,可用下列哪种物质灭火( )
| A、水 | B、沙土 |
| C、泡沫灭火器 | D、干粉灭火器 |
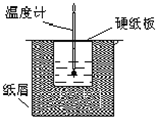 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: